科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-31
来源:iNature
尽管最近的进展为探讨肺纤维化(PF)的发病机制提供了理论依据,但罕见的抗PF治疗方法显示出其治疗肺纤维化(PF)的可行性。反复的肺上皮损伤导致损伤修复反应和炎症反应,从而推动PF的发展。2019年8月27日,中国医学科学院药物研究所胡卓伟研究团队在Immunity上发表了题为Targeting the Tranional Factor C/EBPβ Degradation Reduces Lung Fibrosis by Restoring Activity of the Ubiquitin-Editing Enzyme A20 in Macrophages的研究论文。该研究表明GSK-3b-A20-C/EBPb轴在AMS中的调节机制可能是治疗PF和纤维增生性肺病的潜在靶点。

许多形式的间质性肺疾病(ILD)导致肺纤维化(PF),这是一种由反复肺损伤和炎症引起的慢性进行性病理改变。特发性肺纤维化(IPF)是ILD最常见的形式,具有不可逆性的PF和不良的临床疗效。尽管美国食品和药物管理局(FDA)已批准吡非尼酮和九丁尼用于治疗IPF,但这些药物只能减缓IPF的进展。
因此,了解PF的发病机制对于寻找有效的抗PF药物至关重要.肌纤维母细胞是PF最重要的效应细胞,在肺泡和肺间组织中产生大量的细胞外基质。肌纤维成纤维细胞的分化和激活是由肺泡上皮细胞和免疫细胞释放的多种细胞因子和生长因子触发和维持的。在免疫细胞中,肺泡巨噬细胞(AMs)与活化的肌纤维成纤维细胞非常接近,可引发慢性炎症和PF。
最近,一些小鼠的发育谱系追踪研究表明,一个受伤的肺至少包含两个AMs的亚群体,即单核细胞衍生的AMs(Mo-AMs)和组织驻留的AMs(TR-AMS)。事实上,一些研究表明,在受损的肺组织中表现出前炎症和纤维化表型的Mo-AMs在促进PF的发育方面发挥着关键作用。然而,Mo-AMs是如何维持炎症前型和纤维化型的,以及它们如何促进PF的发展还有待进一步阐明。
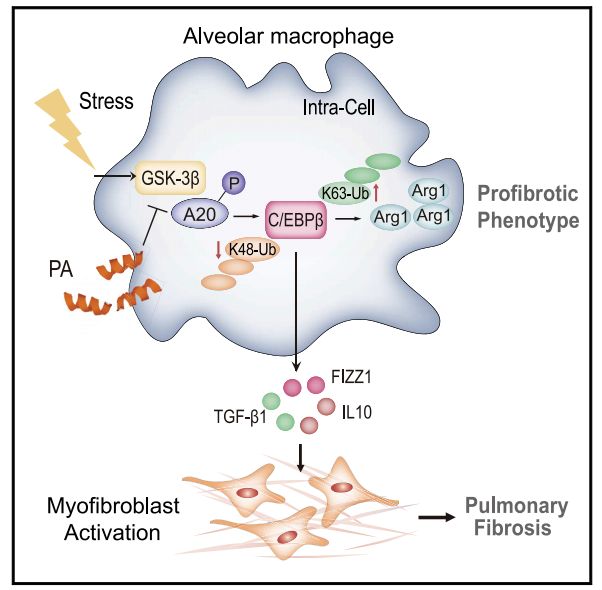
在这里,该研究报道慢性肺损伤使泛锡编辑酶A20失活,导致PF患者和小鼠肺泡巨噬细胞(AMS)中转录因子C/EBPb逐渐增多,增加了许多促进PF发展的免疫抑制因子和促纤维化因子。在慢性肺损伤时,糖原合成酶激酶-3b(GSK-3b)与A20相互作用,磷酸化A20,抑制C/EBPb降解。A20异位表达或通过干扰A20-GSK-3b作用恢复A20活性,加速了C/EBPb的降解,对实验性PF具有较强的治疗作用。该研究表明GSK-3b-A20-C/EBPb轴在AMS中的调节机制可能是治疗PF和纤维增生性肺病的潜在靶点。
原文链接:
https://doi.org/10.1016/j.immuni.2019.06.014来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247503999&idx=7&sn=3c33c53e648c25657cf2bd9ef089254c&chksm=fce6a3a0cb912ab659e980eef62250bdd9f69023b34cf4dcef8840f2d12fc91b9ebdba59f4a9&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

补充甲状腺素有助防治肺纤维化

独家原创|硬皮病治疗研究进展及治疗指南演变
PNAS:肺脏细胞的转化或是肺纤维化发生的关键

新法治疗肺纤维化效果好

Acta Mechanica Sinica 2016年度全体编委会工作会议纪要

Rbm7——严重肺纤维化的新突破口
中国科学家揭示肺纤维化治疗新机制
科学家研发用于诊断肺纤维化的小分子荧光探针

刘毅教授:告别缺医少药 肺纤维化治疗再获突破

PNAS:睡眠时间过长或过短,都易导致肺纤维化