科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-19
来源:BioArt
原标题:Sci Adv:尤启冬/张健合作组发现Hsp90-Cdc37蛋白-蛋白相互作用抑制剂
蛋白-蛋白相互作用是生命体中的基本事件之一,是生物体进行自我调控的一种手段,存在于几乎全部的生物学事件中。在蛋白的生命周期中,人热休克蛋白家族Heat Shock Proteins (HSPs) 与肿瘤、恶性炎症、神经退行性疾病等均具有直接关系,HSPs家族核心成员Hsp90被视作极具前景的新型药物靶标和肿瘤生物标志物。在众多的Hsp90客户蛋白中,蛋白激酶类是与肿瘤的发生与发展高度相关的。其中,绝大多数的蛋白激酶需要Cdc37蛋白的协助才能完成Hsp90伴侣循环的过程,最终实现蛋白的装配成熟与释放。与传统的Hsp90 ATPase竞争型抑制剂相比,阻断Hsp90-Cdc37相互作用可以选择性地影响特定的蛋白激酶类客户蛋白,而非全部的Hsp90客户蛋白,以此来避免并克服Hsp90 ATPase竞争型抑制剂在临床上表现出的毒副作用。因此,Hsp90-Cdc37蛋白-蛋白相互作用可能成为一种新型且有效的癌症治疗靶标【1】。
目前设计Hsp90-Cdc37蛋白-蛋白相互作用的抑制剂所面临的主要困难有:(1)Hsp90-Cdc37的相互作用过程为动态过程,结合位点在各个作用阶段并不固定,难以找到关键的作用位点;(2)目前尚未发现特异性的小分子或具有明确结合模式的内源性配体,缺少设计模板及测试方法【2-3】。
9月18日,Science Advances杂志在线发表了中国药科大学尤启冬教授和上海交通大学张健教授课题组合作研发的Hsp90-Cdc37蛋白-蛋白相互作用的First-in-class小分子抑制剂DDO-5936,题目为Small-molecule inhibitor targeting the Hsp90-Cdc37 protein-protein interaction in colorectal cancer。该工作首次阐明Hsp90-Cdc37相互作用的结构特征及特异性的小分子抑制剂。
本研究首先通过长程的分子动力学模拟蛋白-蛋白相互作用过程中的动态变化,计算Hsp90-Cdc37动态结合过程中的结合自由能并将其分解至结合面的单氨基酸位点,得到了动态结合面中单氨基酸残基对结合的贡献大小。基于此计算结果,通过构建关键位点突变蛋白,逐一验证了结合面的关键氨基酸残基,首次证明了Hsp90蛋白中的Glu47、Gln133与Cdc37蛋白中的Arg167形成的氢键作用网是Hsp90-Cdc37蛋白-蛋白相互作用第一阶段的关键,其中任一氨基酸的突变会造成全部亲和力的丧失。因此,此关键相互作用所在的结合区域成为了抑制剂设计的重要基础。
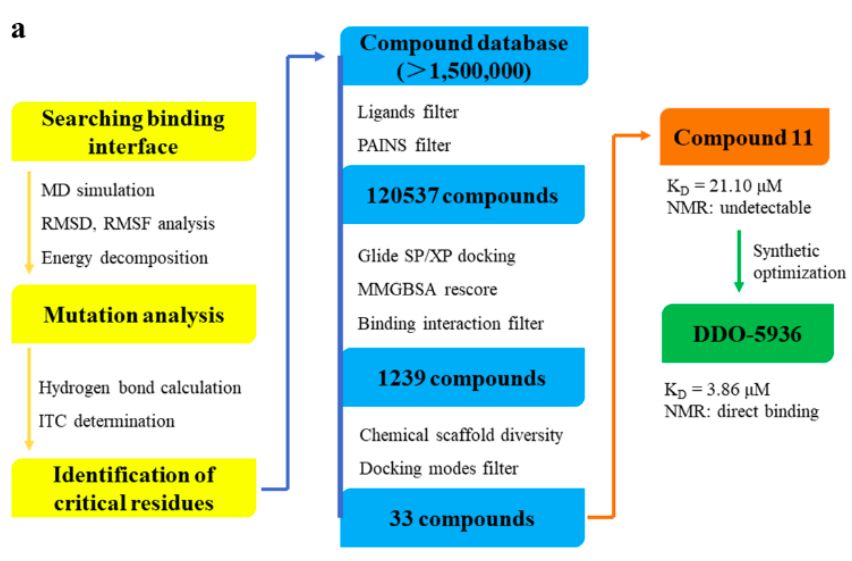
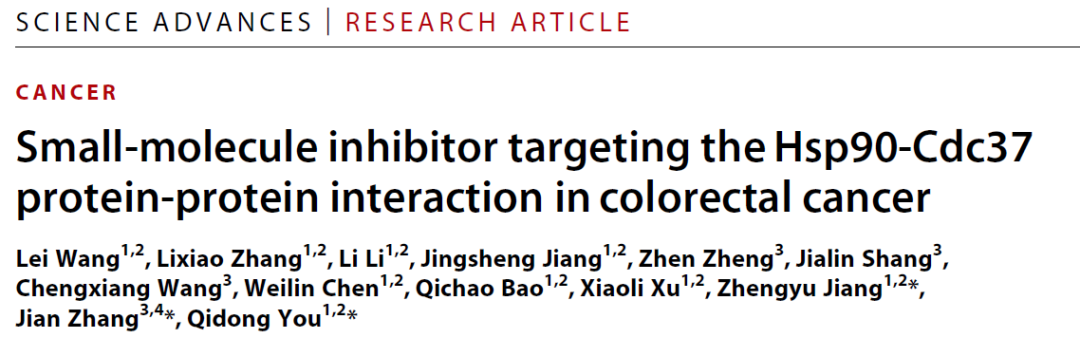
图1. 先导化合物筛选流程
在深入地研究了Hsp90-Cdc37蛋白-蛋白相互作用表面的识别机制后,基于前期实验结果,课题组进一步开展了针对此非经典动态相互作用的抑制剂设计策略。建立了Hsp90-Cdc37特异性小分子聚焦库,通过级联对接特异性筛选可以靶向于关键相互作用网络的小分子,随后筛选其结合模式并计算其结合自由能,最后通过体外高通量筛选得到了先导化合物compound 11(图1)。通过进一步的结构优化,得到了亲和力更高、结合模式明确、细胞内有效的Hsp90-Cdc37蛋白-蛋白相互作用调控剂DDO-5936,其体外亲和力达到低微摩尔级别。
细胞内作用机制研究结果表明,DDO-5936阻断Hsp90-Cdc37相互作用后对激酶类客户蛋白的直接降解影响较小,而是阻滞其磷酸化的成熟过程,以此达到抗肿瘤细胞增殖的效果。进一步研究发现,DDO-5936具有较高的靶标特异性,显著抑制细胞周期,下调CDK2, CDK4,CDK6等细胞周期蛋白,并在体内药效学研究中表现出了初步的有效性,为阻断Hsp90-Cdc37蛋白-蛋白相互作用作为抗肿瘤新靶标提供了重要的药理学证据和优质的小分子先导化合物(图2)。
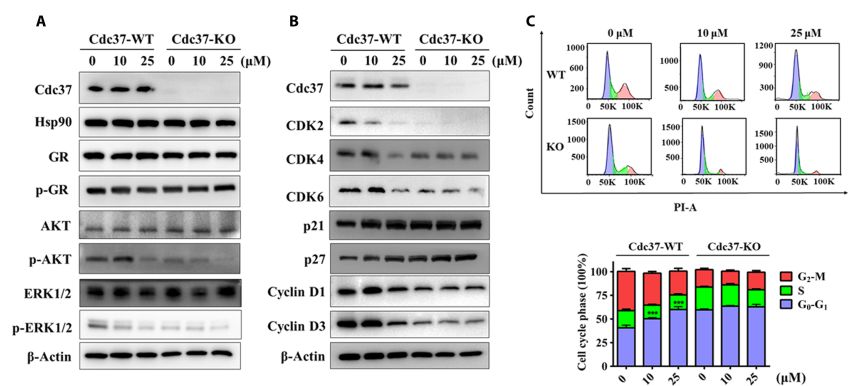
图2. DD0-5936选择性抑制Hsp90激酶信号通路,阻断细胞周期进程
据悉,中国药科大学尤启冬教授团队长年致力于研发靶向于复杂蛋白-蛋白相互作用的小分子调控剂。本工作不仅为调控靶标Hsp90在肿瘤中的药物研发开辟了全新的思路,而且提供了优质的先导化合物。尤启冬教授课题组王磊博士为本论文第一作者,尤启冬教授,张健教授和姜正羽副教授为通讯作者。
原文:
http://dx.doi.org/10.1126/sciadv.aax2277
参考文献
1. Wang L, Li L, Gu K, et al. Targeting Hsp90-Cdc37: A Promising Therapeutic Strategy by Inhibiting Hsp90 Chaperone Function. Current Drug Targets 2017;18:1572-85.
2. Wang L, Li L, Zhou Z H, et al. Structure-based virtual screening and optimization of modulators targeting Hsp90-Cdc37 interaction. Eur J Med Chem 2017;136:63-73.
3. Verba K A, Wang R Y R, Arakawa A, et al. STRUCTURAL BIOLOGY Atomic structure of Hsp90-Cdc37-Cdk4 reveals that Hsp90 traps and stabilizes an unfolded kinase. Science 2016;352:1542-47.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475453&idx=6&sn=6ce6383d8b365c82b6c9ae0650538bae&chksm=84e20389b3958a9fbb580669b36b3a146214643e96c35d2fd0473f1dc28b67de89f797014127&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

两篇science背靠背,新的研究热点或将开启
颅内非特异性感染
特异性人源寨卡病毒抗体找到了
Nat Nanotechnol | 纳米颗粒实现器官特异性基因编辑!
减数分裂细胞中组蛋白去甲基化酶底物特异性
Nature | 为生物大分子的特异性标记提供理论基础——含炔烃氨基酸的生物合成
胰腺特异性抗原(PaA)
【化学生物学】氧化还原反应控制的位点特异性α2–6唾液酸酸化

Nature Cancer :三特异性抗体可提高肿瘤免疫效果
前列腺特异性酸性磷酸酶