科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-24
来源:肠道君营
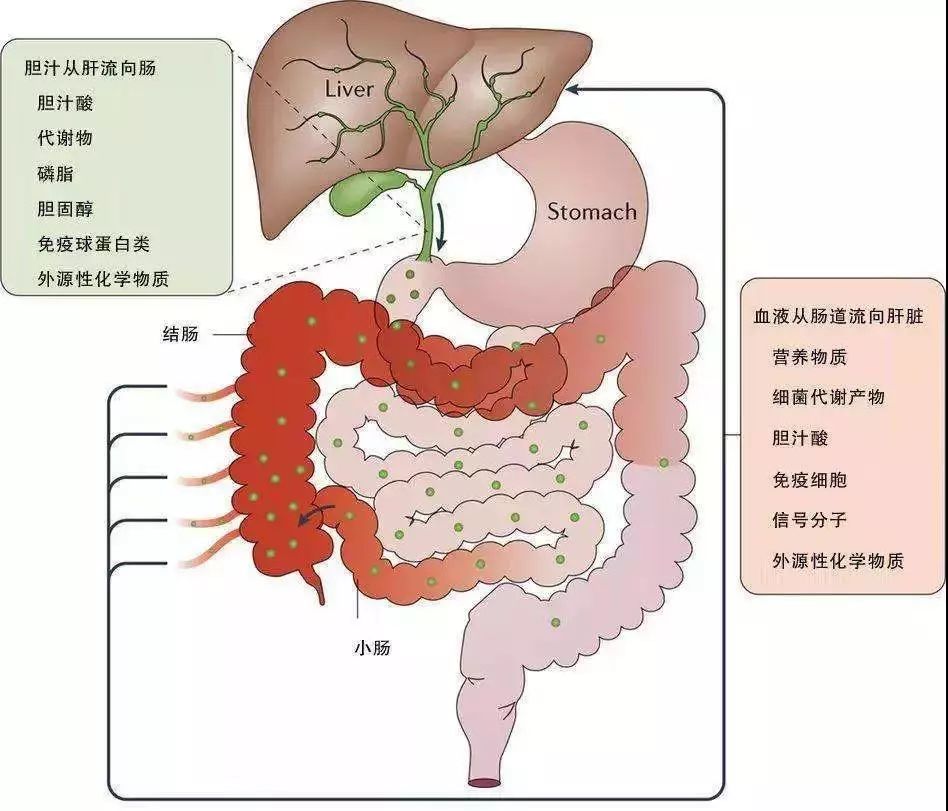
肝脏是人体最大的解毒中心,也是食物吸收进入血液后的第一道防御屏障。能够分解代谢体内毒性物质并且阻止细菌代谢产物进入人体循环。
肠道及肠道菌群在人体新陈代谢及生理机能中发挥重要的作用。肠道及肠道菌群与肝脏之间存在着密切联系,从肠道所吸收的营养成分和非营养成分都会从门静脉进入肝脏。但是这个通道并不是单向的,实际上是双向的。这个双向通道就叫“肠肝轴”。也就是说肝脏可以影响肠道尤其是肠道菌群,反过来肠道通过肠道菌群又来影响肝脏。
具体通路是这样的:肝脏合成的胆汁酸和其它生物活性物质会通过胆囊管分泌到小肠上部,这些成分沿着小肠、结肠这个通路往下走,在这个过程中,肠道及肠道内的微生物则代谢内源性的胆汁酸和外源性的其它物质,然后再通过门静脉吸收入血再重新流回到肝脏内。如此往复循环。
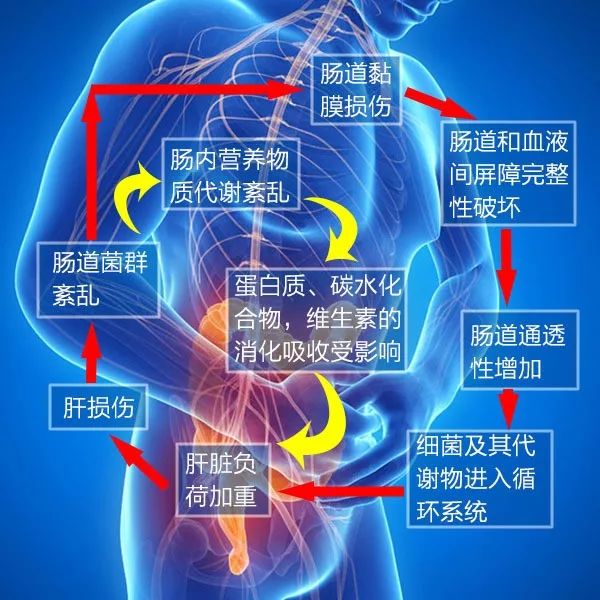
肠道菌群失调可以产生相关毒素物质并通过薄弱的肠道屏障进入肠肝循环中,从而加重肝脏疾病的进展。有效的干预肠道菌群失衡有利于延缓或阻止慢性肝病的发生发展。
中华医学会感染病学会主任委员、中国工程院院士李兰娟在这块做了大量研究也取得了重大成果,相关研究表明肠道菌群在肝病发展中扮演重要角色,双歧杆菌等被认为对人体有益的肠道微生物,在肝病患者中普遍存在着紊乱现象。针对肝病患者中肠道菌群失调情况,调节肠道菌群有可能延缓慢性肝病的进展。
正常肠道菌群是人体的一道天然屏障,许多证据表明,肠道细菌过度增长、肠道通透性增加以及肠道免疫损伤是细菌移位产生的三个主要因素,细菌移位进而参与并导致了肝脏疾病并发症的发生。因此,近年来肠道菌群在慢性肝病中的作用日益引起学术界重视。
2011年,课题组研究人员通过高通量测序技术发现,肝硬化患者的粪便菌群与健康对照组相比存在显著差异,其中肠杆菌、链球菌等相对增加,毛螺菌等相对减少,这表明肝硬化患者存在肠道微生态失衡。
研究发现被认为是有益菌的细菌,在肝病患者中存在的种类组成和健康人群明显不同,比如研究人员对双歧杆菌分析,发现肝病患者双歧杆菌的种类组成会受到肝病严重干扰,肝硬化患者中发现链状双歧杆菌减少,而齿状双歧杆菌明显增加。在针对乳杆菌研究,发现肝硬化患者中种群多样性显著减少。而研究发现肝病患者中缺少发酵乳杆菌和鼠李糖乳杆菌。
肠道菌群失调会引发或加重很多疾病,尤其是慢性肝病,而慢性肝病反过来也会加重肠道菌群失调。如果能搞清楚这些机制,尤其是肝炎患者中哪些细菌是增加的,哪些是减少的,然后把增加的清除掉,减少的那些帮助增加,将来有望利用菌群来用于慢性肝病治疗。
肠道菌群与肝性慢病
酒精性肝病
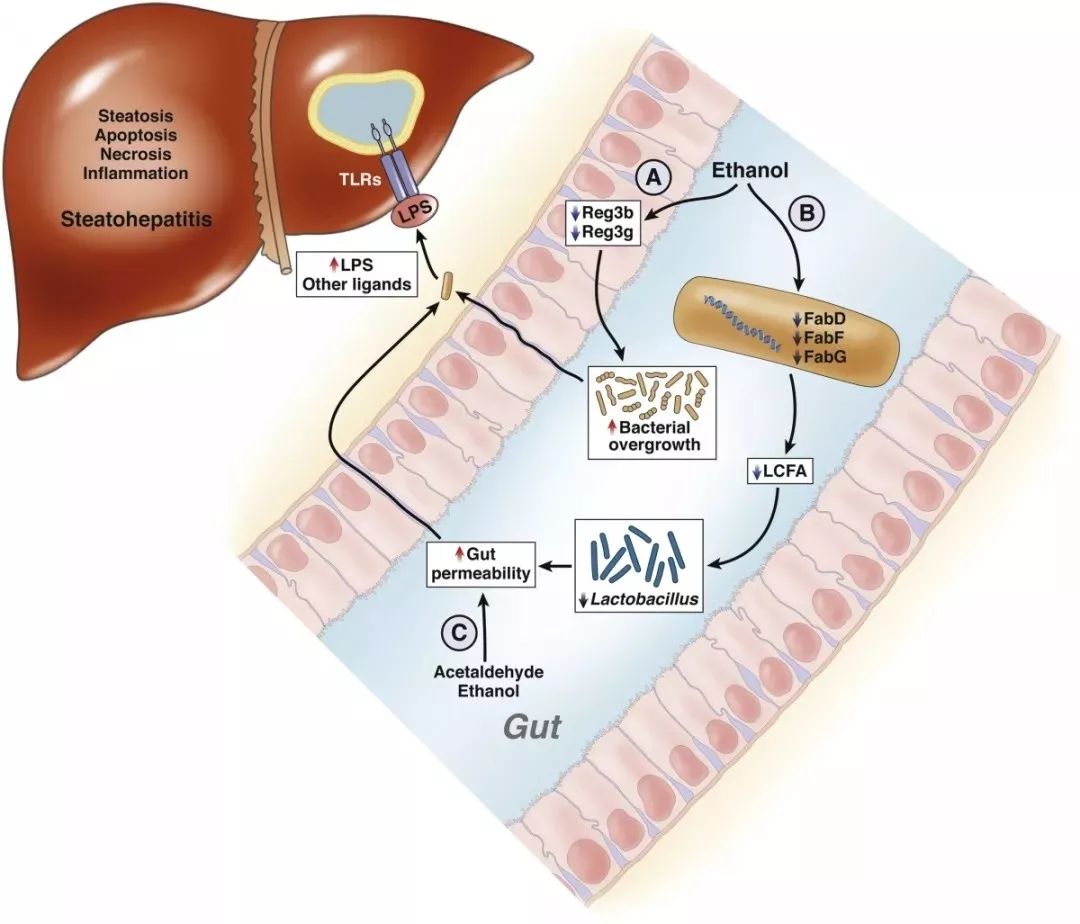
酒精性肝病(ALD)包括脂肪肝、肝脂肪变性及其他严重病变,如酒精性肝炎、肝硬化、肝细胞癌和肝衰竭。感染是导致一部分 ALD 患病及死亡的原因,研究发现 ALD 患者的肠道通透性(IP)增加,可能导致肠道有关的内毒素血症。这一发现说明了肠道免疫与酒精毒性、酒精性肝炎的严重程度有关,也证实肠道微生物对酒精的保护机制。
通过定量粪培养比较正常人和嗜酒者的肠道菌群发现,酒精中毒患者肠道双歧杆菌、肠球菌和乳酸菌种类较少。对 36 名酒精性肝硬化患者的粪便微生物 16S rRNA 基因的 V3 区域进行测序,发现肝硬化患者的变形杆菌和梭状杆菌数量较多,而拟杆菌数量减少,此外在科属层面,肠杆菌科、韦荣球菌科和链球菌科在肝硬化患者中普遍存在。
非酒精性脂肪性肝病
非酒精性脂肪肝(NAFLD)是代谢综合征在肝脏的表现,往往发生在超重的人群中,同时伴有高血糖、血脂异常和高血压等代谢综合征组分。NAFLD 在西方国家是最常见的肝脏疾病,其病理表型广泛,从脂肪变性 (SS)、非酒精性脂肪性肝炎 (NASH) 到终末期肝病或肝硬化。
出生时的肠道微生物形成可能会影响非酒精性脂肪肝的发展。一项研究 191 名 NAFLD 儿童的研究,发现母乳喂养可降低进展为 NASH 或肝纤维化的风险。此外,人类基因组缺乏一些酶去代谢碳水化合物,所以肠道微生物在代谢复合碳水化合物中起着关键作用。
例如,拟杆菌和厚壁菌都编码碳水化合物消化酶,但是拟杆菌编码的消化酶比厚壁菌多。通过 16SrRNA 测序分析了 NASH 儿童和健康对照组的粪便微生物,发现非酒精性脂肪性肝炎和肥胖患者的拟杆菌/厚壁菌比值更高;与肥胖及健康人群相比,非酒精性脂肪性肝炎患者的埃希氏杆菌浓度更高。
原发性硬化性胆管炎(PSC)
关于 PSC 患者的菌群微生物研究较少。一项日本的研究发现 PSC 患者微生态失调的相关证据,通过 16SrRNA 测序比较 27 名 PSC 儿童、16 名 UC 儿童以及正常对照组的粪便微生物。PSC、UC 患者 Parabacteroide 属较少,而肠球菌含量较高。与 IBD 患者相比,PSC 患者的菌群多样性减少,肠球菌、梭形杆菌、乳酸菌过剩,特别是韦荣球菌属数量增加。
原发性胆汁性肝硬化(PBC)
微生物与 PBC 的发病机制密切相关。测定42 名早期 PBC 患者的粪便微生物,发现 PBC 患者中有益菌较少,如酸杆菌、Lachnobacterium、拟杆菌和瘤胃球菌。而机会致病菌数量增加,如γ-变形菌、肠杆菌、奈瑟氏菌、螺旋体、韦荣球菌、链球菌、克雷伯菌、放线杆菌、Anaeroglobus、肠杆菌、嗜血杆菌、巨型球菌和 Paraprevotella。
肝硬化
肝硬化患者的粪便微生物中拟杆菌水平降低,而变形菌、梭菌属水平增高。同时肝硬化患者的自生菌种偏少,如 Blautia、氏菌属、Fecalibacterium、Dorea。而肝硬化患者的乙状结肠黏膜的微生物也与正常人群明显不同,如罗氏菌减少,而肠球菌、韦荣球菌、巨型球菌和伯克霍尔德菌增加。
通过调节肠道菌群是治疗肝硬化的重要策略。乳果糖是肝硬化和肝性脑病患者的一线治疗用药,近期一项回顾性分析发现乳果糖可减少肝硬化并发症的发生,如肝衰竭、肝肾综合征、静脉曲张出血,并可降低肝硬化死亡率。
慢性肝病与肠道菌群权威研究一览
Nature Reviews:肠道菌群与酒精性肝病
酒精可影响肠道菌群的组成及功能,尤其是胆汁酸代谢, 酒精可通过肠-脑轴损伤脑功能,从而进一步增加酒精的滥用,加速肝性脑病的发展;肝纤维化患者的肠道菌群随着肝损伤的发展而发生变化,内毒素产生菌增加而原有的细菌分类群减少;
随着酒精性肝病的病程进展,患者的肝脏胆汁酸产生及细菌对胆汁酸的转化等功能随之发生变化;
戒酒+调节菌群(益生菌、粪菌移植等)的治疗策略可用于改善酒精性肝病。
原文:Alcohol, liver disease and the gut microbiota.
Gut:非酒精性脂肪肝病患者的肠道菌群代谢物
除遗传和环境因素外,肠道菌群及其产物的变化也参与非酒精性脂肪肝病(NAFLD)的发病;肠道屏障功能紊乱可促进NAFLD,但研究显示仅少数患者存在肠道通透性和菌群产物移位增加。
菌群衍生代谢物作用于不同的受体和通路,影响代谢和NAFLD,三甲胺、一些次级胆汁酸、乙酸和丙酸、内源性乙醇等可促进NAFLD发病,丁酸可抑制NAFLD;琥珀酸、苯乙酸和3-(4-羟苯基)乳酸酯等菌群产物,或能作为生物标志物用于NAFLD的检测。
原文:Small metabolites, possible big changes: amicrobiota-centered view of non-alcoholic fatty liver disease.
Gastroenterology:粪菌移植有助于防止肝性脑病复发
对HE(肝性脑病)患者的肠道菌群和健康对照组的状况进行评估,与对照组相比,HE患者表现出了相对更少的毛螺科菌和瘤胃菌科的生长。
这些参与者首先接受了5天的FMT前的抗生素,其后通过灌肠接受了90毫升(27克大便)含有大约 2.7X1012的菌落形成单位的粪菌供体。SOC(标准化治疗)参与者未接受任何干预或抗生素治疗。所有参与者都在试验全程接受了乳果糖,利福昔明和质子泵抑制剂(PPIs)的治疗。
数据安全监测委员会表明在研究的5个月间没有发生任何FMT相关的严重不良反应事件。
对所有参与者的随访时长都在 12个月至15个月之间,研究人员关注了患者的住院情况和HE的阶段。在长期随访中对患者进行了认知功能测试(PHES)并获取了他们的粪便样本,以对患者使用抗生素治疗后、接受FMT前与接受FMT后早期的粪便样本数据进行比较,并采用16S测序对患者不同阶段的微生物组成进行了研究。
总的来说,对FMT组患者进行的干预措施有很好的效果,并且FMT表现出了长期安全性——没有感染,也没有需要使用新的抗生素的情况。
在长期随访中观察到,SOC组与FMT组相比有着更高的住院率和更远的肝硬化发展阶段。SOC组发生了10次住院事件(其中有2位病人每人住院2次,6位病人每人住院1次),而FMT组中只有1位病人有过1次住院经历(P=0.05)。
大部分病人的住院原因都跟肝脏相关(SOC组中:HE,n = 4;感染,n = 2;腹水,n = 2 ; FMT组中:腹水=1)。2个患有感染(1艰难梭菌和1肺炎)的SOC组的参与者需要接受短疗程广谱抗生素的使用。SOC组共发生HE 8次,而FMT组的HE发生次数为0(P = 0.03)。
FMT组在接受FMT 20天后,认知功能开始改善,且长期来看FMT组的认知功能比SOC组得到了显著提高。
原文:Long-term Outcomes After Fecal Microbiota Transplantation in Cirrhosis.
Nature Medicine:寒冷诱导的胆固醇转化为胆汁酸改变肠道菌群、促进适应性产热
寒冷暴露的小鼠可以引发代谢性程序,即在棕色脂肪组织(BAT)中进行脂蛋白处理,以及通过替代合成途径在肝脏中将胆固醇转化为胆汁酸。这个过程依赖于肝脏诱导的细胞色素P450、家族7、B亚家族、多肽1(CYP7B1),并且导致胆汁酸血浆水平的升高,以及粪便排泄增加。胆汁酸伴随着肠道菌群的明显变化,可以增加产热。
研究人员发现有针对性的靶向胆汁酸合成和排泄进行遗传学和药物干预,可以防止粪便胆汁酸排泄增加,改变肠道细菌的菌种组成,并且调节机体的产热反应。
这些结果表明胆汁酸是持续的BAT激活条件下一个重要的代谢效应因子,并强调了宿主对饮食诱导的肠道微生物群和能量代谢变化与胆固醇代谢的相关性。
原文:Cold-induced conversion of cholesterol to bileacids in mice shapes the gut microbiome and promotes adaptive thermogenesis.
Lancet Gastr Hepat:肠道微生物如何导致小儿肝病
肠道微生物可以调节肠粘膜的渗透性并帮助将食物分解成小分子,从而直接影响肝脏健康。
多项研究发现肠道菌群失调与肝脏疾病的严重程度和进展相关联,如非酒精性脂肪肝、非酒精性脂肪性肝炎、原发性硬化性胆管炎、全肠道外营养相关性肝病和囊性纤维化相关性肝病。
但是,尚没有足够的信息可以解释微生物如何在小儿中导致这些肝病。因为在出生时,肠内菌群存在很大差异,而且,3岁后菌群才会建立稳定的定植。研究者在本文中论述关于肠道菌群与肝病进展的联系和改变儿童肠内微生物的治疗方式。
原文:The intestinal microbiome and paediatric liverdisease.
Hepatology:肠道菌群移植,HBeAg持续阳性患者的福音
肠道菌群在免疫清除HBV中发挥重要作用。一些研究揭示罹患肝脏硬化的慢乙肝患者有着不同于正常人群的微生物群。“渗漏假说”把肠道菌群同肝病进展联系起来。
方法:使用恩替卡韦或替诺福韦酯进行抗病毒治疗时间超过3年且持续HBeAg阳性的18位患者纳入研究。根据患者意愿,5位患者纳入肠道菌群移植组,其余13位患者纳入对照组。所有患者继续以往的抗病毒治疗。
签署知情同意书后,每4周对肠道菌群移植组进行胃镜下的肠道菌群移植,直到HBeAg得以清除。1位患者在进行了5次肠道菌群移植后退出实验组,其余4位接受1到7次的肠道菌群移植。
结果:与基线相比,移植组的患者HBeAg滴度明显降低,且表现为每次移植后逐渐减低。在移植组,2位患者在一次移植后实现HBeAg清除,1位患者在4次移植后实现。相比之下,对照组没有患者出现HBeAg清除。HBV DNA在每次移植后4周进行检测,均低于检测下限。随访结束,没有观察到HBeAg再转换。移植组患者治疗期间未出现腹部不适、腹泻、便秘等显着的不良反应。
原文:Fecal microbiota transplantation induces hepatitisB virus e-antigen (HBeAg) clearance in patients with positive HBeAg afterlong-term antiviral therapy.
Clinical Gastroenterology and Hepatology:肝硬化患者的肠道菌群特征
研究分析181例肝硬化患者入院时的粪便菌群特征与之后30天内临床症状的关联;
研究发现患者中8%发展为慢加急性肝衰竭(ACLF)、16%转入重症监护、21%死亡;
有/无上述临床症状结局的患者相比,菌群β多样性差别显著,发展出ACLF(尤其伴随肾衰竭)的患者,菌群失调更严重;
变形菌门中肠杆菌科、弯曲杆菌科和巴斯德菌科、厚壁菌门中肠球菌科和链球菌科,与不良临床症状结局相关,而厚壁菌门中毛螺菌科和梭菌目可降低不良临床症状结局风险;
原文:Association Between Intestinal Microbiota Collectedat Hospital Admission and Outcomes of Patients with Cirrhosis.
综上,调节肠道菌群对多种慢性肝病具有重要的治疗意义,尤其是肝硬化失代偿期患者中微生态失调更显著。未来需要进行更大型的队列研究,进一步证实及说明慢性肝病中的微生态变化,从而发现新的治疗途径去降低慢性肝病的发病率及死亡率。
来源:huiguoguoyongjiejie 肠道君营
原文链接:https://mp.weixin.qq.com/s?__biz=MzU4NjQ5OTMxOQ==&mid=2247485493&idx=1&sn=d26c96aafac8435eb7d3198b871ce1a5&chksm=fdfb1dadca8c94bbddd119dea212a01dda35fd65e533aaa233359f03d4c987b731595227ca16&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
健康 肠道菌群 微生物 粪菌移植 肝硬化 胆汁酸 微生物发酵 粪便移植 慢性肝病 肝病饮食
【研究】Nature子刊:发酵配方奶粉喂养下婴儿体内免疫、微生物群和代谢组的成熟
《Gut》权威发布:粪便银行在粪菌移植临床实践中的国际共识

阳光照射可改变肠道微生物菌群

解析农林牧生物废弃物发酵微生物,为腐生型食用菌栽培基质制备提供支撑
中科院科学家在微生物固体发酵生产γ-聚谷氨酸研究中获进展
Cell:肠道菌群又立功!粪便移植或能让“癌王”患者长寿
【论文精选】木薯渣基质化发酵微生物分离及复合菌配制
趣味科学:仰卧起坐会导致瘫痪,这是真的吗?

人体肠道菌群与恶性肿瘤:肠道微生物群调节影响化疗药物的疗效和毒性(三)

肠道微生物影响记忆?今日《自然》揭示菌群变化如何改变大脑