科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-28
来源:BioArt
调节性T细胞(Regulatory t cell, Treg cell)是一类具有免疫抑制功能的淋巴细胞,在维持机体免疫系统功能平衡,调节机体免疫耐受和对抗炎症反应中具有至关重要的作用。Treg细胞自身稳态和功能的异常与自身免疫疾病、过敏、慢性感染和肿瘤等疾病密切相关,是近年来免疫学领域研究的热点。效应T细胞(Effector T cell, Teff cell)在受到抗原刺激后被迅速活化、增殖、迁移到炎症发生部位,并释免疫活性物质进行免疫应答。然而,在自身免疫疾病中,Teff细胞往往出现异常免疫应答,释放多种炎症因子,诱发和加重炎症反应。此时,Treg细胞则通过负调控Teff细胞的功能抑制免疫反应。因此,Treg细胞和Teff细胞的功能调控以及相互制衡对于调节免疫反应具有重要意义。
2020年10月27日,加州大学圣地亚哥分校医学院,联合法国图卢兹大学和康涅狄格大学卫生院的科学家在Journal of Experimental Medicine(JEM) 上在线发表了题为Distinct Integrin Activation Pathways for Effector and Regulatory T cell Trafficking and Function的工作(第一作者为孙昊博士),该研究揭示,不同于对Teff细胞的调控,整合素活化可以通过独特的信号通路调控Treg细胞的功能。通过对多种免疫性肠炎小鼠模型的研究,作者发现抑制信号通路中的RIAM可以抑制Teff细胞加重炎症反应的作用,同时不影响Treg细胞抑制炎症反应的功能,从而更精准的治疗炎症性肠炎(IBD)或其他自身免疫性疾病【1】。

IBD是一种肠道自身免疫疾病,患者免疫应答异常导致肠道组织的破坏,具有慢性、复发性等特征。近几十年来,诸多科学家逐渐从分子层面揭示了IBD的发病机理,发现T细胞向肠道的迁移增加是IBD患者异常免疫应答的关键。那么如何控制淋巴细胞向肠道的迁移,成为IBD治疗药物研发的热点。维得利珠单抗(Vedolizumab)与肠道T细胞表面的整合素α4β7结合后,抑制其活化,从而阻止淋巴细胞向肠道迁移。该作用具有肠道特异性,目前是IBD理想治疗药物。然而与许多其他生物制剂类似,使用Vedolizumab与临床无应答率高相关,约有36%–54%的患者对Vedolizumab治疗无应答。
孙昊博士的前期工作发现β7(Itgb7)缺失反而会使小鼠结肠炎恶化【2】。该发现被复制到2种不同的结肠炎小鼠模型中。研究表明,β7的丧失破坏Teff细胞(坏人)迁移至肠道的能力,从而对肠道炎症具有保护作用;然而,β7的丧失会同时破坏Treg细胞(好人)迁移至肠道的能力。所以,当IBD病人有其他联合疾病,导致体内Treg细胞数量减少或功能降低,破坏了Treg细胞和Teff细胞的平衡时,可能面临α4β7阻断疗法失败的风险。
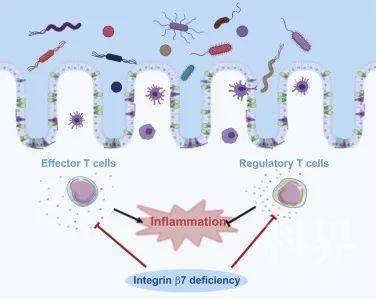
β7在肠道炎症中的功能示意图
在本项研究中,孙昊博士以及同事接着对整合素功能调控蛋白进行了深入研究,希望能找到更有前景的IBD靶点,有疗效并且副作用少。通过研究整合素活化的信号通路,作者发现激活整合素的途径在Treg细胞和Teff细胞上是不同的。在Teff细胞上,整合素通过Rap1/RIAM/Talin信号途径被活化;而在Treg细胞上,整合素通过Rap1/Lamellipodin (Lpd)/Talin信号途径被活化。RIAM和Lpd隶属于同一个家族,作用相似,但是由于其在两种细胞上的表达水平不同,各自分别在不同细胞上起到主要作用。作者进一步发现,阻断RIAM的功能影响Teff细胞的黏附和迁移,同时对Treg细胞并无任何影响,并且RIAM基因(Apbb1ip)缺失的小鼠非常健康,这恰恰是一个理想的IBD药物靶点。通过对多种与人类IBD相似的免疫肠炎小鼠模型的研究,作者发现抑制RIAM确实极大的缓解小鼠的疾病进程,并且没有副作用产生,从而实现更精准的治疗炎症性肠炎(IBD)或其他自身免疫性疾病。
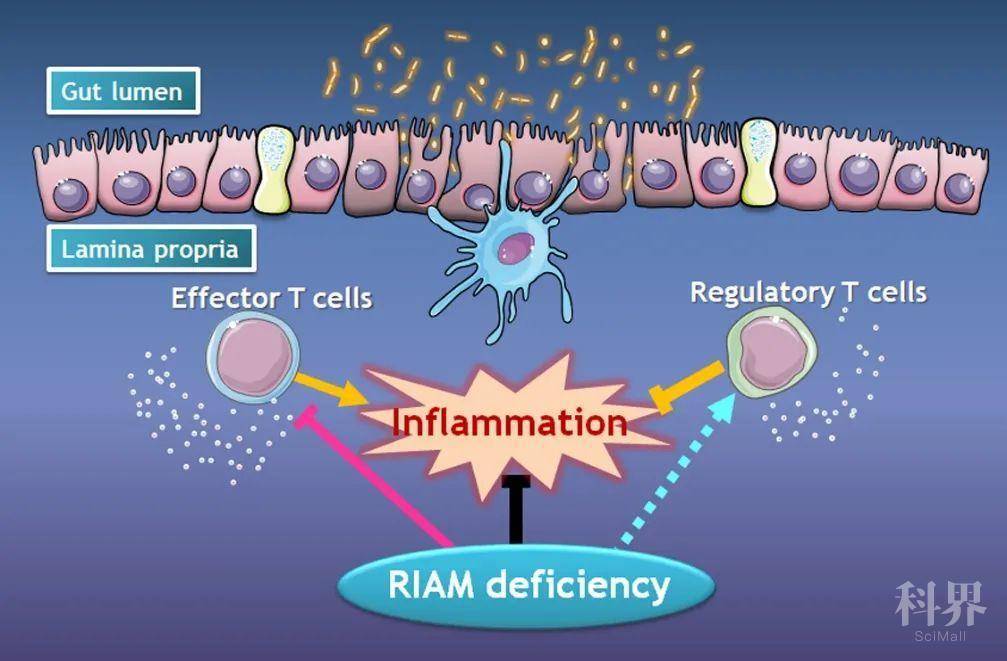
RIAM在肠道炎症中的功能示意图
这项工作只是揭露了冰山一角,Treg细胞抑制功能的调控仍有待进一步研究,找出调控Treg细胞功能的关键分子能够加深人们对Treg细胞功能调控机制的认识。据悉,目前孙昊博士正在积极着手筛选Treg细胞特异性的整合素激活抗体以及小分子化合物,可望为自身免疫疾病的临床治疗提供新线索和新靶点。
原文链接:
https://rupress.org/jem/article-abstract/218/2/e20201524/211498/Distinct-integrin-activation-pathways-for-effector?redirectedFrom=fulltext
参考文献
1. H Sun, F Lagarrigue, H Wang, ZC Fan, ML Ramirez, J Chang, and MH Ginsberg. Distinct Integrin Activation Pathways for Effector and Regulatory T cell Trafficking and Function. J. Exp. Med. 2020. 10.1084/jem.20201524
2. H Sun, W Kuk, J Rivera-Nieves, MA Lopez-Ramirez, L Eckmann, MH Ginsberg. 7 Integrin Inhibition Can Increase Intestinal Inflammation by Impairing Homing of CD25hiFoxP3+ Regulatory T Cells. CMGH., 2020.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652505257&idx=7&sn=a1fe0b65a91588226e0185b43cd16490&chksm=84e1971db3961e0bc48f49eeea1d0fd72f6826ec832d995b5ec718a0c92d93ab9b66e046f292&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
上海巴斯德所发现调控调节性T细胞稳态和抑制性功能 的重要转录因子及分子机制

肿瘤免疫治疗丨调节性T细胞及其应用
Nature | CRISPR筛选发现调节性T细胞中Foxp3新的调节因子

效应性及调节性T细胞之间的PD-1表达平衡可以预测PD-1阻断疗法的临床疗效
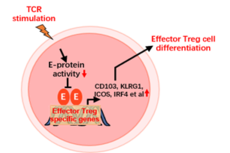
微生物所在效应性Treg细胞分化的转录调控研究中取得进展
肠道微生物的遗传变异与人类疾病相关

没做一个实验,背靠背发了两篇32分的nature子刊

Cell | 免疫信息的多代传递决定肠道调节性T细胞的命运

控制调节性T细胞发育的生化“开关”找到

周旭宇/高福合作发现核糖体的合成可以选择性控制调节性及常规T细胞的活化