科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-06
来源:BioArt
2015年发表在Cell杂志上的两篇论文中,两组研究人员表明通过限制细胞的方式对细胞施加物理压力,会导致之前静止的细胞开始快速移动。但细胞是如何被挤压到重新定位的机制还不清楚。现在,这两个独立团队再次发现,细胞核负责感知压力的变化,并触发导致细胞运动的信号级联。10月15日这两项研究同时发表在Science杂志上,分别题为The nucleus acts as a ruler tailoring cell responses to spatial constraints以及The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior。


“即使在五年前,人们也会摇摇头说,细胞核不过是蛇里面的保龄球而已(a bowling ball inside of a snake),”卡内基梅隆大学的化学家Kris Dahl说,“由于细胞内含有DNA,细胞核就是一个很大、稠密且不必要的东西,细胞不得不在绝望中拖着它前进。”Dahl补充说:“虽然之前有证据表明细胞核可以将机械力从细胞的一边传递到另一边,但现在才真正证明这个观点。”
维也纳圣安娜儿童癌症研究所的细胞生物学家Alexis Lomakin解释说:“与人相似,组成人体组织和器官的细胞也在保护其某种形式的个人空间。”
在2015年研究结束后,两个研究小组都想了解是什么信号导致细胞在受到限制时开始移动。他们在较早的论文中表明,细胞皮层区域内肌球蛋白II的收缩触发了运动,但是感知细胞变形然后激活肌球蛋白II却是一个悬而未决的问题。
Lomakin于2015年成为巴黎居里研究所的客座科学家,他想解决细胞为何在受限状态下会收缩的问题,因此他与苏黎世联邦理工学院生物物理学家Daniel Müller的研究生CédricCattin合作。Cattin、Müller和他们的同事在2015年使用了微观悬臂来限制细胞,Lomakin和Cattin共同致力于将该技术应用于精确量化细胞对外部压力的反应。
与此同时,巴塞罗那基因组调控中心的发育生物学家Verena Ruprecht和她的同事们正在努力实现类似的目标。“我们探索的关键问题是,细胞感觉到它已经变形了吗?” 另Ruprecht说,“它如何激活这种细胞骨架变化程序,然后导致像逃避反射一样的突然迁移的?”
巴塞罗那光子科学研究所的生物物理学家Stepre Wieser和 Ruprecht团队专注于斑马鱼细胞外表面蛋白质的蛋白,这些蛋白被限制在培养物中盖玻片下方,以观察这些蛋白质中是否有任何一个导致细胞从不转移到移动,但他们并没有发现感知机械变形的粘附蛋白或离子通道。因此,他们将注意力转向了细胞核。
“细胞核是非常大且突出的细胞器,当挤压细胞时,很明显细胞内的细胞器受到了影响,因此我们当时在想,也许传感器不在表面,但实际上是在细胞内部,” Ruprecht说。他们注意到,只有当细胞被压缩到足以影响细胞核时,肌球蛋白II才似乎富集。
Lomakin及其同事使用他们的微观悬臂进行了类似的观察,并提出细胞核起着传感器的作用,该传感器在变形时会向细胞发出信号,以寻求更多的空间。为了将核变形与细胞运动联系起来,研究人员在人类癌细胞中进行了小分子筛选,确定了细胞内钙离子、核包膜中的拉伸敏感蛋白以及一种称为胞质磷脂酶A2(cPLA2)的酶。
Ruprecht研究小组也集中在cPLA2上。在2016年的一项研究中,纪念斯隆·凯特琳癌症中心的Philipp Niethammer小组显示,炎症或渗透压过程中的核肿胀以及钙信号传导可以激活cPLA2。看到这项研究后,Ruprecht团队测试了cPLA2在斑马鱼细胞培养系统中的作用。
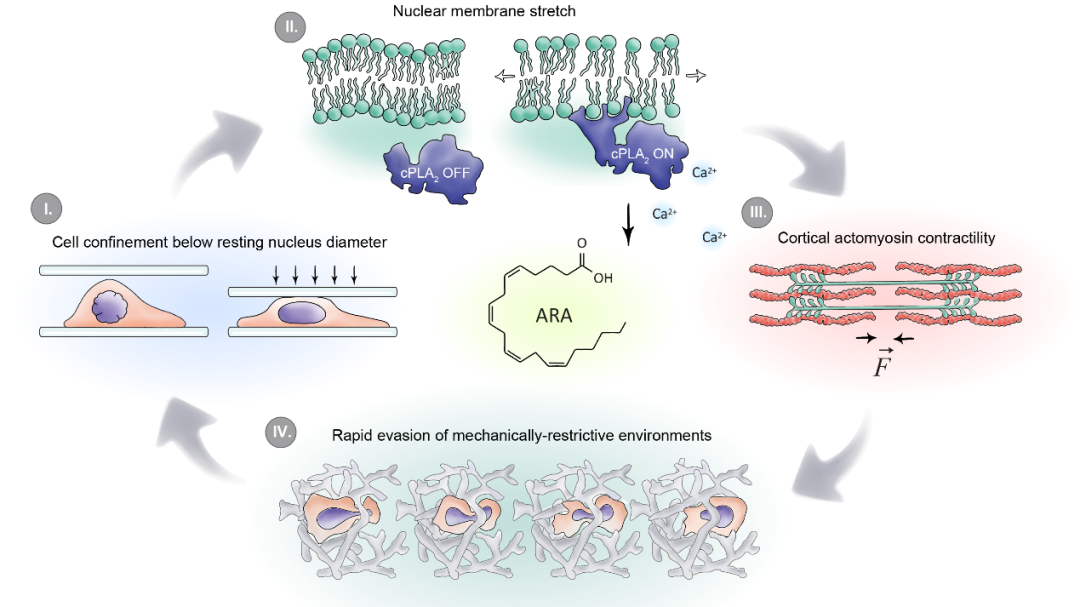 当细胞限制变得小于核的静止直径时,核就会变形(I)。然后,核被膜伸展并展开,导致张力触发钙释放,cPLA2活化以及随后生成花生四烯酸(II)。下游信号产生肌动球蛋白力(III)和增加的细胞运动性(IV)。
当细胞限制变得小于核的静止直径时,核就会变形(I)。然后,核被膜伸展并展开,导致张力触发钙释放,cPLA2活化以及随后生成花生四烯酸(II)。下游信号产生肌动球蛋白力(III)和增加的细胞运动性(IV)。
两个研究组都发现,当细胞核被挤压时,其包膜伸展并展开,释放钙离子并从核质内向内核膜募集cPLA2。酶的移动激活了它,并导致释放其主要的裂解产物花生四烯酸,然后花生四烯酸在细胞质中发送了一系列信号,最终触发了肌球蛋白II的活性,从而将核压缩与细胞运动联系了起来。
“两个独立小组使用不同方法得出了相同的结论,”康奈尔大学的生物学家Jan Lammerding说,“这确实增进了我们对核如何帮助感知机械应力的理解。”
Lammerding告诉The Scientist杂志:“这两个研究小组找到了关键机制,但是在将来是否还有其他机制?如果有的话,它们是否独立,这是很有趣的研究。在不同的核机械传感机制之间,以及在核与细胞质机制之间,可能存在多少相互作用和交联?”
除了有关其工作原理的问题外,研究人员对可能的应用潜能感到兴奋。Lomakin说,癌细胞利用“这种机制逃脱了拥挤的环境或是机械狭窄的环境”,这意味着它可以成为癌症治疗的目标。“初步数据表明,用小分子抑制剂下调cPLA2的活性可能会干扰肿瘤细胞脱离原发肿瘤并转移到远处器官的能力。”
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652506795&idx=7&sn=011661057c670b2d7d67283a8cc27c4a&chksm=84e1991fb3961009bc95d85ca2e48af0bd164b2f4e96b330c4a279731e0ce8bc4b2fbaa5e57b#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人工细胞与生物细胞首次实现成功融合与协作

学术造假必遭严惩,为何仍不断有人冒险
上海有机所揭示全新细胞核程序性坏死通路

张先恩团队发现HIV-1可借助核内吞方式进入细胞核
《自然》:如何从细胞核中移除不必要的细胞组分?
一个小小的细胞就有多达4200万个蛋白质分子

NCB:细胞衰老中细胞核自噬底物新成员 SIRT1

人体细胞内存在“铁路”系统,能自动优化结构

细胞核中暗藏被忽视的分子机制
失去细胞核的细胞在3D环境中举步维艰