科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-19
来源:BioArt
撰文 | 章台柳
肿瘤细胞具有快速增殖的特性,需要生物大分子提供能量和生物合成,以实现不断增殖的需求。营养限制被认为是治疗肿瘤的潜在策略,但是肿瘤细胞通过改写代谢途径,能够在营养限制的环境中存活。肿瘤细胞中非必需氨基酸的合成已经被证明能够阻碍治疗效果。例如,谷氨酰胺通过谷胱甘肽的生物合成,能够支持肿瘤细胞中蛋白质合成增加和抗氧化应激,而且为三羧酸循环提供原料,并产生ATP和合成核苷酸、氨基酸、脂质的前体【1】。在没有外源谷氨酰胺的条件下,肿瘤细胞可以从头合成谷氨酰胺,但不能从头合成天冬酰胺。谷氨酰胺限制抑制肿瘤生长的原因就是不能维持细胞内天冬酰胺的水平,因此降低细胞内天冬酰胺的水平或将是限制肿瘤生长的重要步骤【2】。
天冬酰胺合成酶(asparagine synthetase,ASNS)催化天冬氨酸转化为天冬酰胺,伴随着谷氨酰胺脱酰胺反应。急性淋巴细胞白血病中ASNS的表达缺陷导致其对天冬酰胺限制敏感,但是,在ASNS低水平表达的实体瘤中,天冬酰胺限制对其没有效果【3】。那么实体瘤中肿瘤细胞如何对天冬酰胺限制产生抵抗及相关分子机制,目前尚未清楚。
2019年11月18日,来自美国的Ze’ev A. Ronai 在Nature Cell Biology上发表了题为Translational reprogramming marks adaptation to asparagine restriction incancer的文章,揭示了黑色素瘤和胰腺癌细胞中,天冬酰胺限制可激活RTK-MAPK-mTORC1通路,进而激活翻译重编程,增强MNK1、eIF4E的翻译,MNK1和mTORC1协同增加ATF4 mRNA的翻译。抑制MAPK能够破坏ATF4及其靶标基因ASNS的上调,使肿瘤细胞对天冬酰胺限制更加敏感,限制其生长。此外,ASNA的低表达可以用来预测黑色素瘤病人对MAPK通路抑制剂是否响应的预测因子,而且ASNA的低表达和较低的MAPK活性与良好的预后相关。

研究团队首先在胰腺癌、乳腺癌、前列腺癌、黑色素瘤等细胞系中敲低ASNS的表达,发现显著降低天冬酰胺的水平,并且抑制细胞系的增殖,回补L-天冬酰胺能够逆转这种表型。同时,ASNS缺失导致GCN2的活化,以及eIF2α磷酸化增加、ATF4蛋白及其靶标基因的表达增加,表明氨基酸响应(amino acid response,AAR)通路被激活。而且破坏GCN2-ATF4通路能够增强天冬酰胺限制对肿瘤细胞的抗增殖效果。
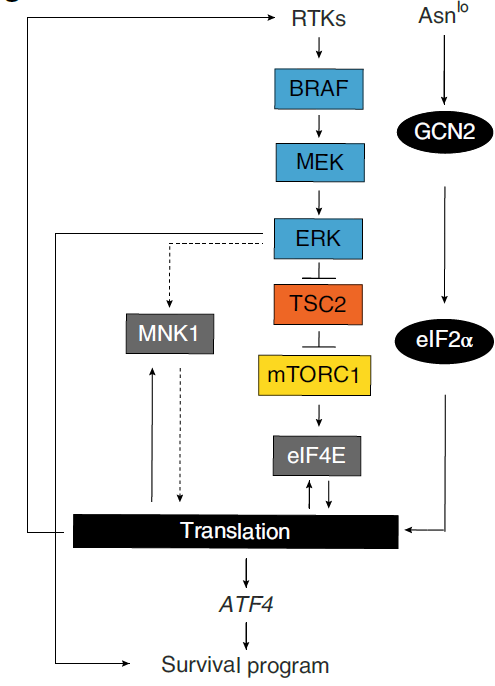
生物信息分析显示受体酪氨酸激酶(VEGFR2)、血小板衍生生长因子受体(PDGFRA、PDGFRB)、MAPKKK BRAF、MNK1(MAPK信号的效应蛋白和翻译起始的调控因子)和Polo样激酶1(一个Ser/Thr激酶,通过c-RAF磷酸化激活MAPK信号)等被预测与ASNS是协同致死(SL)关系,其中多项与MAPK信号相关。同时失活ASNS和预测的SL基因显著降低肿瘤导致的死亡。相比于ASNAhi细胞系,ASNAlo对预测的SL蛋白的抑制剂更加敏感。而且,ASNS的表达是预测BRAF抑制剂响应的最强因子之一。单独的BRAFi能够抑制黑色素瘤细胞的增殖,但与ASNS缺失联合能够更高效。抑制MAPK信号(抑制BRAF、MEK或ERK)破坏了ASNS缺失诱导的GCN2-ATF4通路及ATF4靶标基因的上调。ASNS缺失增强MEK和ERK的磷酸化,形成正反馈机制。ASNS缺失导致细胞内丝氨酸、甘氨酸、丙氨酸和乳酸水平增加,BRAF或MEK抑制剂能够抑制这种现象。病人中ASNS和BRAF的同时下调预示着其预后更为良好。综上,MAPK信号在ASNS缺失诱导ATF4表达及相关表型、代谢变化中有重要作用。
MAPK信号如何调控ATF4表达?黑色素瘤细胞中,ASNS缺陷导致TSC2的磷酸化增加,抑制mTORC1负调控因子TSC2的活性,激活mTORC1信号,而BRAF抑制剂能够阻断该表型。mTORC1可通过磷酸化4E-BPs使其失活,促进mRNA 5’帽子结合蛋白eIF4E而刺激蛋白质合成。ASNS缺陷细胞中,敲低eIF4E、抑制mTOR都能够阻断ATF4及其靶标基因的上调。进一步分析ATF4的翻译状况,发现ASNS缺陷增加ATF4 mRNA的翻译,而BRAF抑制其翻译。而且mTORC1的抑制增强ASNS缺失诱导的抗增殖效应。故在ASNS缺陷细胞中,MAPK-mTORC1-eIF4E信号介导的翻译重编程增强ATF4 mRNA的翻译。除此之外,翻译重编程过程增加MNK1、eIF4E的翻译,导致蛋白含量增加。MNK1能够通过直接磷酸化eIF4E调控翻译过程,参与调控ASNS缺陷诱导的ATF4 mRNA翻译增加,但不参与调控mTORC1活性。
RTKs是MAPK信号的上游,而且协同致死预测中显示VEGFR2、PDGFRA、PDGFRB是ASNS的SL同伴。在ASNS缺陷细胞中,VEGFR2的转录增加,VEGFR2和PDGFRB的蛋白水平增加,而且检测到VEGFR2和PDGFRB mRNA的翻译增加。抑制RTKs信号能够阻断ASNS缺失导致的MEK1/2、ERK1/2磷酸化增加和ATF的上调。其中敲低VEGFR2尤为有效,几乎完全破坏ATF4及其靶标基因的上调。所以,RTK信号是MAPK通路的上游调控,确保ASNS缺陷导致的ATF4上调。
最后,研究人员对天冬酰胺限制和MAPK信号抑制剂联用的抗肿瘤效果进行探索。KPC/B6胰腺癌和NRAS突变黑色素瘤模型中,L-Aase(L-天冬酰胺酶)和MEKi两者联用(所使用浓度均不能抑制肿瘤生长)显著抑制胰腺癌的生长,而且降低肿瘤细胞的增殖,促进凋亡;两者联用显著增强MEKi对癌细胞肺转移的抑制作用。MEKi有效抑制L-Aase导致的ERK1/2磷酸化增加,ATF4及其靶标基因(包括ASNS)的上调。选取15位黑色素瘤患者,在接受BRAFi 或BRAFi和MEKi联用治疗前取样进行RNA-seq分析。发现治疗反应良好的患者其ASNA的表达显著较低,而且ASNS的表达对MAPK抑制治疗的应答具有高度的预测作用。研究人员进一步收集2群独立的人群数据——转移性黑色素瘤接受BRAFi或BRAFi+MEKi治疗前、后的配对肿瘤样本,进行RNA-seq分析,发现对MAPK抑制剂产生抵抗与高表达ASNS相关。
总之,本项研究报道了肿瘤细胞通过RTK-MAPK-mTORC1通路重编程翻译过程,促进ATF4及其靶标基因的上调,从而适应天冬酰胺限制的环境,并揭示了天冬酰胺限制和MAPK通路抑制剂联用的抗肿瘤效果,为两者联用的临床应用提供了理论依据,为新型肿瘤治疗提供了新的视角。
原文链接:
https://doi.org/10.1038/s41556-019-0415-1
参考文献
1. Altman, B. J.,Stine, Z. E. & Dang, C. V. From Krebs to clinic: glutamine metabolism tocancer therapy. Nat. Rev. Cancer 16, 749 (2016).
2. Gwinn, D. M. etal. Oncogenic KRAS regulates amino acid homeostasis and asparagine biosynthesisvia ATF4 and alters sensitivity to l-asparaginase. Cancer Cell 33,91–107 (2018).
3. Bachet, J. B.et al. Asparagine synthetase expression and phase I study with l-asparaginaseencapsulated in red blood cells in patients with pancreatic adenocarcinoma. Pancreas44, 1141–1147 (2015).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477929&idx=4&sn=fa8d0c29e57382395bb1dc4ed5b44d83&chksm=84e20a5db395834b0270e797f748aa6ff32b1a486f6ccf912f58830f643f2168f4540d76f53a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

【科普】学会正确区分痣与黑色素瘤
美研发出黑色素介质疗法,有望根治黑色素瘤


纳米载体精准送药杀灭黑色素瘤

黑色素瘤或有免疫治疗新方案

“免疫+双靶”——黑色素瘤超豪华方案来了~

恶性黑色素瘤放疗候选药物问世

诱导色素沉着能防小鼠黑色素瘤

在黑色素瘤病人中检测循环流动肿瘤细胞的敏感无创平台

痣能变癌?专家教你识别黑色素瘤

Mol Carcinogen:新药可饿死黑色素瘤细胞