科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-20
来源:BioArt
造血干细胞(Hematopoietic stem cell,HSC)处于造血谱系分化的顶端,能够在体内产生所有类型的血液细胞,通过自我更新和多系分化来维持整个生命体的血液系统。胚胎发育中,经典的观点认为造血干细胞通过内皮生血转化(endothelial to transition,EHT)产生于胚胎的主动脉-性腺-中肾(aorta-gonad mesonephros,AGM)区【1-3】,刘兵研究员团队(李专作为第一作者)揭示了胚胎头部与AGM区类似,是胚胎造血干细胞产生的位点,并通过谱系示踪小鼠模型发现胚胎头部内皮细胞来源的造血干细胞,最终部分贡献成体的造血系统,诠释了头部来源的内皮细胞的生理贡献【4】。在经典的造血位点AGM区,造血干细胞的产生受到不同的因子和信号通路所调控。但是胚胎头部内皮生血过程,未形成造血细胞蔟,仅仅以单细胞形式产生,提示胚胎头部造血发育微环境的独特性【5】。
巨噬细胞的研究目前在国际上非常热门方向之一。原始巨噬细胞形成于E7.5的小鼠胚外卵黄囊血岛。不像其他组织特异巨噬细胞,稳态条件下,原始巨噬细胞是成体的头部巨噬细胞(小胶质细胞)唯一来源(图一)【6】。小胶质细胞功能多样,比如参与调控神经系统分型和促进胚胎期头部血管网的形成。但是胚胎头部巨噬细胞对造血发育的调控研究未见报道。
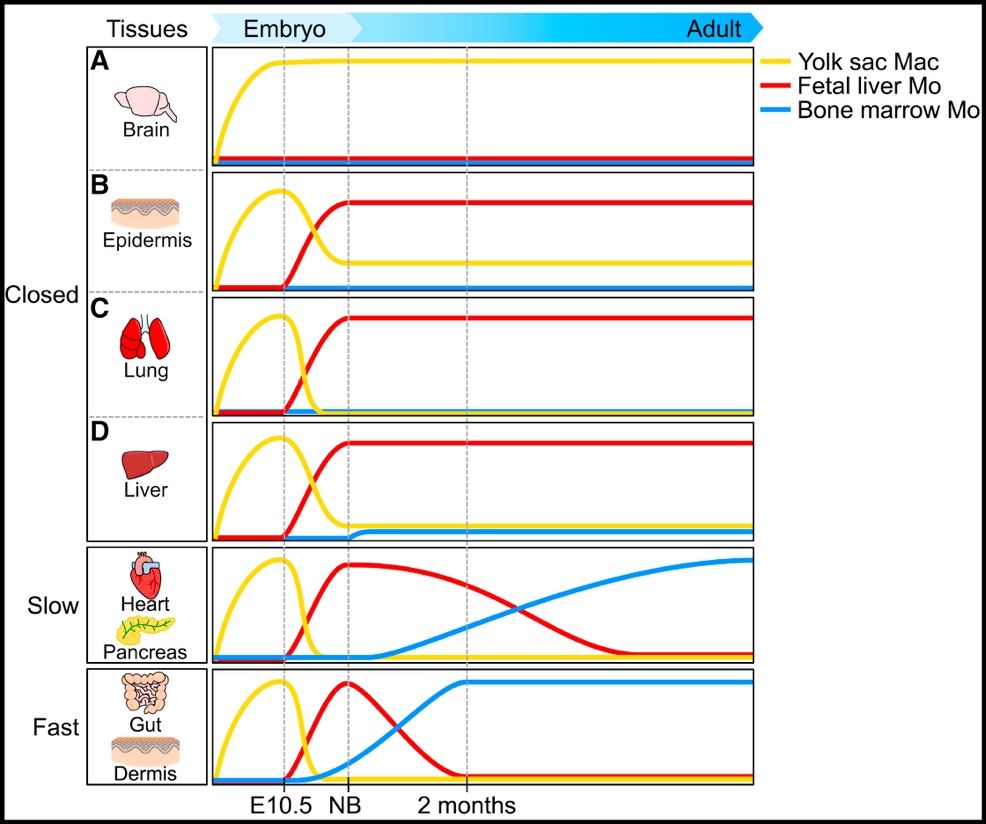
图一:稳态下成体组织中组织特异性巨噬细胞个体发育的异质性【6】
2019年11月11日,爱丁堡大学皇后医学研究所Eliane Dzierzk研究团队在Blood 杂志发表了题为 A role formacrophages in hematopoiesis in the embryonic head的研究论文。该研究阐述了胚胎头部巨噬细胞造血干祖细胞发育的调控作用,并解析胚胎头部巨噬细胞通过分泌促炎性因子来影响胚胎头部内皮生血过程。

作者首先解析了胚胎头部巨噬细胞的表型CD45+F4/80+CD11b+Gr1-以及巨噬细胞特异的标志Csf1r。利用Csf1r-GFP小鼠模型发现胚胎头部巨噬细胞分散在脑血管内皮细胞周围。此外,胚胎头部巨噬细胞表达趋化因子受体CX3CR1,而胚胎头部内皮细胞高表达趋化因子CX3CR1的配体 CX3CL1,提示巨噬细胞和胚胎内皮细胞的相互作用的可能性。趋化因子CX3CR1-GFP KI/KO的模型显示趋化因子缺失导致胚胎头部造血祖细胞的下降,尤其是红系发生。
随后,利用巨噬细胞特异的Csf1r-Cre;RosaDTA小鼠模型(特异性去除巨噬细胞),发现巨噬细胞缺失导致胚胎头部造血祖细胞明显下降。同时,利用长期重建移植实验发现巨噬细胞缺失的小鼠胚胎头部未检测到功能性造血干细胞的存在。

图二:巨噬细胞缺失导致胚胎头部造血干祖细胞下降。
最后,优化的OP9-DL1共培养体系,发现胚胎头部巨噬细胞能够促进头部来源的内皮生血的发生。利用半定量PCR分析发现巨噬细胞高表达促炎性细胞因子相关基因IL1a/b和TNFa,内皮细胞表达相关受体。通过Elisa分析,在蛋白水平验证巨噬细胞分泌促炎性细胞因子TNFa。外源性TNFa的加入,能够替代巨噬细胞促进内皮来源造血祖细胞的形成,并呈剂量依赖性,从而提示巨噬细胞分泌TNFa来调控胚胎头部造血发生。
图三:巨噬细胞促进胚胎头部内皮造血转化。
综上所述,卵黄囊来源的巨噬细胞定居于胚胎头部,通过趋化因子/趋化因子受体和促炎性信号分子通路来调控胚胎头部造血干祖细胞的发育,对胚胎头部巨噬细胞的功能进行了补充,从而为造血再生提供新的策略和手段。
李专教授(原爱丁堡大学博士后,2018年7月入职南方医科大学)作为论文的第一作者并和Elaine Dzierzak教授作为共同通讯作者。解放军总医院第五医学中心刘兵研究员和暨南大学兰雨研究员给予了大力支持。
原文链接:
https://doi.org/10.1182/blood.2018881243
参考文献
1. Chen MJ, Yokomizo T, Zeigler BM, DzierzakE, Speck NA. Runx1 is required for the endothelial to haematopoietic celltransition but not thereafter. Nature.2009;457(7231):887-891.
2. Boisset JC, van Cappellen W, Andrieu-SolerC, Galjart N, Dzierzak E, Robin C. In vivo imaging of haematopoietic cellsemerging from the mouse aortic endothelium. Nature.2010;464(7285):116-120.
3. Bertrand JY, Chi NC, Santoso B, Teng S,Stainier DY, Traver D. Haematopoietic stem cells derive directly from aorticendothelium during development. Nature.2010;464(7285):108-111.
4. Li Z, Lan Y, He W, et al. Mouse embryonichead as a site for hematopoietic stem cell development. Cell Stem Cell. 2012;11(5):663-675.
5. Li Z, Vink CS, Mariani SA, Dzierzak E.Subregional localization and characterization of Ly6aGFP-expressinghematopoietic cells in the mouse embryonic head. Dev Biol. 2016;416(1):34-41.
6. Muller AM, Medvinsky A, Strouboulis J,Grosveld F, Dzierzak E. Development of hematopoietic stem cell activity in themouse embryo. Immunity.1994;1(4):291-301.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478008&idx=6&sn=f684dad2e310fc6c5ec05f0cfbcdc9f9&chksm=84e2098cb395809a9ec51f22f35b63394e9c1184d9ff1eec9b4adcb1950ede386ba51dd0f6bd&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

研究揭示调控造血干细胞髓系分化潜能的分子机制

Apln+血管内皮细胞调控造血干细胞和骨髓移植

肥胖对造血干细胞有负面影响
长期饮食限制使造血干细胞年轻化
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结
我国学者发现炎症巨噬细胞凋亡机制
吃辣除了爽,还能动员造血干细胞!


纳米金-CRISPR系统实现造血干细胞中的基因精准编辑

神奇伟哥的妙用:加速造血干细胞新生!

人类造血干细胞发育首份“路线图”创建