科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-29
来源:BioArt
作为真核生物染色质的基本单位,核小体(nucleosome)由1个(H3-H4)2异四聚物,2个H2A-H2B异二聚物和147 bp DNA装配而成,可以有效地组织基因组DNA【1】。与此同时,这种组织形式会显著地影响所有与DNA相关的细胞活动,比如RNA转录,DNA复制与修复等等【2】。通常,核小体被认为是这些活动的障碍。因此,让核小体先解离(disassembly)或者部分解离可以促进这些进程。同时,由于核小体上带有的表观遗传标记(比如组蛋白异构体和组蛋白修饰等等)是调节基因表达、复制和修复的重要信息,如何在这些进程结束后重新装配(reassembly)核小体去维持它的完整性(integrity)也具有十分重要的意义。
组蛋白伴侣分子(histone chaperone)FACT(Facilitates Chromatin Transcription)被发现在RNA转录过程中可以既降低核小体的稳定性又同时保持其完整性【2】。人源FACT由2个亚基SPT16和SSRP1组成【3】。各种研究证据表明【4-9】,FACT可以通过自身捆绑组蛋白和DNA去促进核小体装配,同时通过其CTD(C-terminus domain)与DNA 竞争H2A-H2B二聚物去促进核小体解体。尽管有大量优秀的结构和生化研究积累,然而FACT 如何同时实现其上述功能的具体机制仍然不清楚。获取完整FACT及其作用底物的结构,成为了当前最重要的方式去深入理解FACT的功能机制。
Dr. Karolin Luger团队 (The University of Colorado at Boulder) 主要研究核小体相关的结构和动力学。FACT结构及其功能研究是实验室一项持续多年的重点。在先前的研究中【4】,研究组找到了FACT的最佳底物:亚核小体(sub-nucleosome)。亚核小体包含79bp ‘601’序列DNA和所有种类的组蛋白。通过优化体外生化合成, 团队获得了稳定的FACT_sub-nucleosome 复合物。
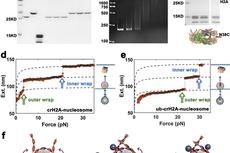
2019年11月28日,Dr. Karolin Luger团队在Nature杂志上发表了文章FACT caught in the act of manipulating the nucleosome,利用单颗粒冷冻电子显微镜(single particle cryo EM)技术,通过添加合理浓度的洗涤剂CHAPS,结合Dr. Bridget Carragher团队 (National Resource for Automated Molecular Microscopy Simons Electron Microscopy Center)的前沿电镜制片技术 ‘Spotiton’,解析了2个不同状态FACT_sub-nucleosome的结构,解析度分别为4.9埃和7.4埃。最后,基于电子密度图组装已知的核小体结晶结构和FACT各基团结晶结构,团队获得了2个结构模型。它们分别代表FACT_sub-nucleosome的2种不同状态。这两个结构,从亚原子水平上,第一次全面而清晰地展现了FACT是如何与亚核小体作用的。

总体上,两个结构都看上去像独轮车(unicycle)。由DNA和 (H3-H4)2 组成的四合体 (tetrasome)像个轮子,H2A-H2B 二聚物像踏板,而FACT则像车架一样横跨轮子之上。
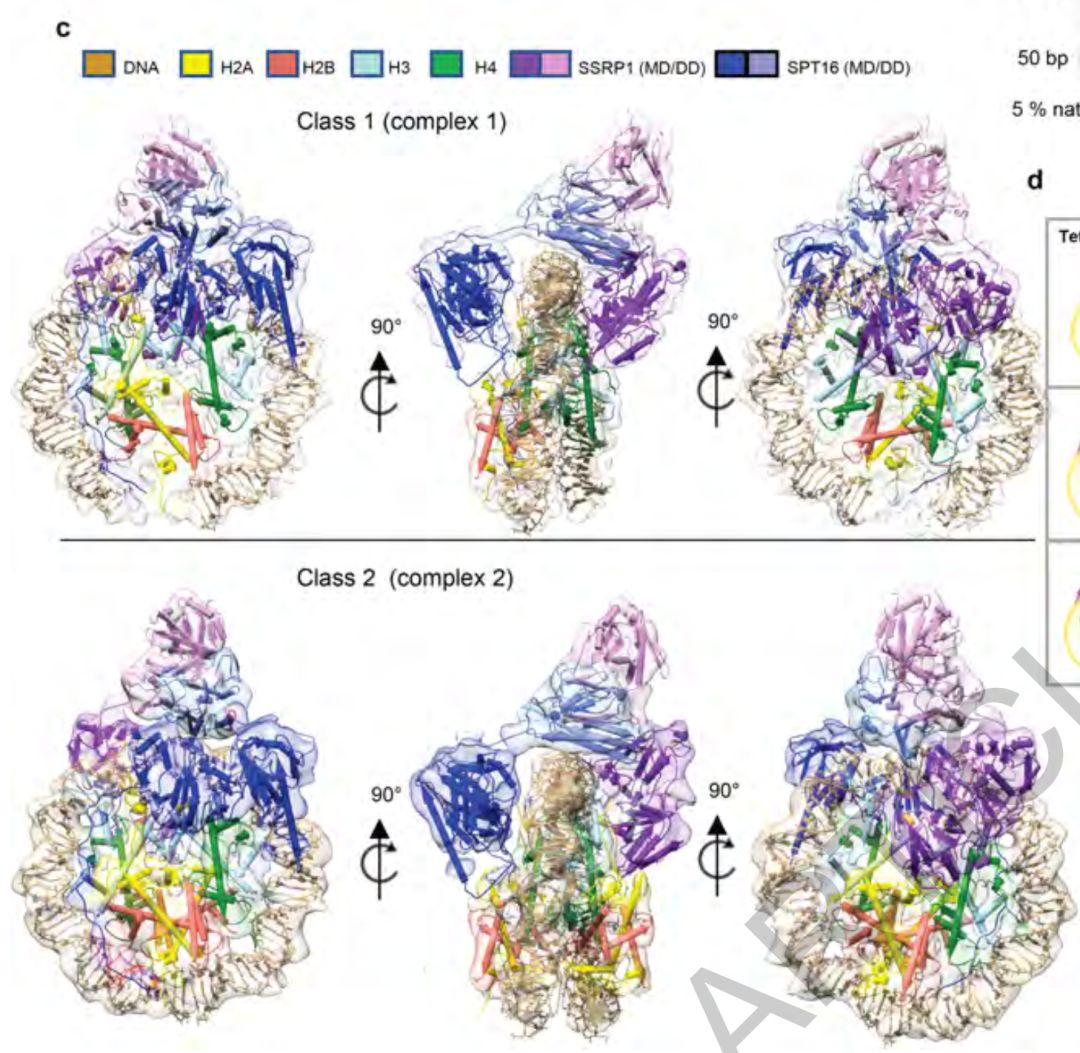
本研究首次发现了由FACT二聚体结构域 (dimerization domains,DD) 和两个中间结构域 (middle domains, MD) 组成的碱性通道。酸性的DNA和此碱性通道同时在电性和构型两方面相互契合而作用。SPT16和SSRP1的MD分别分布于四合体的两边,并且与组蛋白相互作用。虽然FACT具有碱性通道,但是FACT本身并不能在体外单独绑定DNA。本文提出SPT16和SSRP1的酸性CTDs可能动态关闭了碱性通道,而H2A-H2B可以通过结合CTD进而激活FACT的四合体绑定功能,并给出了初步的生化验证。SPT16 CTD的电子密度图清晰地显示了其模拟DNA绑定H2A-H2B异二聚物,从而既能竞争DNA降低核小体的稳定性,又能维持着核小体成分的完整性。Luger团队与Dr. Sheena D'Arcy团队 (The University of Texas at Dallas) 合作,通过氢/氘交换质谱(HDX MS)进一步证实了上述结构信息的可靠性和准确性。
先前由SPT16 MD和(H3-H4)2 组成的复合物的结晶结构揭示了SPT16 MD是如何与(H3-H4)2四聚物 (tetramer)相互作用的【8】。本研究的底物是DNA/(H3-H4)2/H2A-H2B。由于DNA和H2A-H2B占据了原先SPT16 MD 与(H3-H4)2四聚物的作用界面,SPT16 MD使用了另一套与组蛋白的作用界面,并与DNA相互作用。在RNA转录过程中,DNA不可避免地会与RNA聚合酶II相互作用从而短暂离开它与(H3-H4)2四聚物的作用界面,这给SPT16 MD提供了一个转变作用界面的可能。这个转变(从tetrasome到tetramer)可以促进DNA的进一步剥离,同时可以降低H2A-H2B在组蛋白核心的稳定性,还可以维持(H3-H4)2四聚物的完整性和结构。当转录机器通过此处DNA之后,DNA又可以返回来与SPT16 MD竞争,促使SPT16 MD的绑定切回四合体模式,从而完成核小体重新装配 (从tetramer到tetrasome)。这些发现和推论为解答FACT如何促进转录又维持核小体完整性提供了很重要的线索。
两个结构的最大不同处来自于SSRP1分布面。此分布面,复合物1并无H2A-H2B异二聚物出现,从而让复合物1的亚核小体只包含六合体(hexasome)。相对应地,复合物2包含另一个H2A-H2B异二聚物。SSRP1中间结构域经历了重新分布,很好地配合了H2A-H2B的加入,从而避免了结构上的冲突(clash)。复合物1和复合物2的相互转变对于理解SSRP1如何调节核小体远端(nucleosome distal end)H2A-H2B的稳定性具有很重要的启示。
此研究通过解析FACT_sub-nucleosome结构,第一次清晰地展现了FACT是如何与组蛋白及DNA相互作用的,不仅为许多先前的结构和生化研究提供了全面的解释和补充,更进一步深刻地揭示了FACT的功能机制。同时,根据结构提出的几个假说,又为深入研究FACT在各个细胞活动中的动态功能机制提供了非常重要的起点。
Luger团队的刘扬博士和周钶达博士为本文共同第一作者。Karolin Luger博士为本文通讯作者。Dr. Bridget Carragher团队和Dr. Sheena D'Arcy团队为本文的合作单位。
原文链接:
https://doi.org/10.1038/s41586-019-1820-0
参考文献
1. Luger, K., Mäder, A. W., Richmond, R. K., Sargent, D. F. & Richmond, T. J. Crystal structure of the nucleosome core particle at 2.8 Å resolution. Nature 389, 251–260 (1997).
2. Gurova, K., Chang, H., Valieva, M. E. & Sandlesh, P. BBA - Gene Regulatory Mechanisms Structure and function of the histone chaperone FACT – Resolving FACTual issues. BBA - Gene Regul. Mech. 1861, 892–904 (2018).
3. Orphanides, G., Leroy, G., Chang, C., Luse, D. S. & Reinberg, D. FACT , a Factor that Facilitates Transcript Elongation through Nucleosomes. 92, 105–116 (1998).
4. Wang, T. et al. The histone chaperone FACT modulates nucleosome structure by tethering its components. 1, 1–13 (2018).
5. Hsieh, F. et al. Histone chaperone FACT action during transcription through chromatin by RNA polymerase II. 110, 7654–7659 (2013).
6. Chen, P. et al. Functions of FACT in Breaking the Nucleosome and Maintaining Its Integrity at the Single- Nucleosome Level Article Functions of FACT in Breaking the Nucleosome and Maintaining Its Integrity at the Single-Nucleosome Level. Mol. Cell 71, 284-293.e4 (2018).
7. Kemble, D. J. et al. Structure of the Spt16 Middle Domain Reveals Functional Features of the Histone Chaperone FACT . 288, 10188–10194 (2013).
8. Tsunaka, Y., Fujiwara, Y., Oyama, T., Hirose, S. & Morikawa, K. Integrated molecular mechanism directing nucleosome reorganization by human FACT. 673–686 (2016). doi:10.1101/gad.274183.115.
9. Valieva, M. E. et al. Large-scale ATP-independent nucleosome unfolding by a histone chaperone. Nat. Struct. Mol. Biol. (2016). doi:10.1038/nsmb.3321
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478297&idx=2&sn=666524c66f553851ea8dde2a140b48b6&chksm=84e208edb39581fbb38598bd84c296dfab072215575edb0ac29ba070ae5b45040f15305adf08&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
PNAS | 复旦大学研究揭示植物组蛋白分子伴侣识别组蛋白的结构基础
魏勇等-Nature Astronomy:中国的行星探索路线图
董爱武和沈文辉团队合作揭示组蛋白分子伴侣OsChz1调控染色质结构的分子机制
董爱武/麻锦彪组合作揭示植物组蛋白分子伴侣识别组蛋白的结构基础
蛋白质设施用户揭示组蛋白分子伴侣OsChz1调控染色质结构的分子机制
中科院位列2018自然指数榜单全球十大科研机构首位
李祥/阮永怡/黄永瀚合作揭示组蛋白戊二酰化对核小体动态结构的影响

今年热怕了?Nature子刊:别急,未来4年可能更热
研究揭示组蛋白H2A泛素化修饰对核小体的调控机制
Nature论文称,替代新烟碱的杀虫剂仍会伤害蜂群