科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-25
来源:BioArt
责编 | 兮
在病毒或细菌感染下,宿主细胞能通过多种有效途径参与抗感染。其中,病毒感染能诱导宿主细胞改变胆固醇代谢酶和代谢产物的表达,而胆固醇代谢也能调控宿主细胞抗病毒反应。近期国际前沿的工作指出靶向个别关键胆固醇代谢酶或相应代谢产物能提高抗病毒感染的功能。例如敲除胆固醇合成酶SREBP2能升高一型干扰素IFNβ的表达【1】,或者病毒感染诱导胆固醇25-羟化酶(Ch25h)升高表达,导致产物25-羟基胆固醇 (25-HC) 增多,阻断病毒入侵或复制【2-4】。筛查和鉴定其他的胆固醇代谢酶及天然代谢产物抗感染的功能和机制是目前国内外先天免疫研究的关注领域之一。
2019年12月24日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所,简称“分子细胞中心”)王红艳研究员团队与上海大学(原中科院武汉病毒所)魏滨教授实验室合作在Immunity杂志上发表了的研究成果:Targeting 7-dehydrocholesterol reductase integrates cholesterol metabolism and IRF3 activation to eliminate infection,揭示了胆固醇中间代谢产物7- 脱氢胆固醇(7-DHC)和靶向7脱氢胆固醇还原酶DHCR7的抑制剂均能发挥抗多种病毒感染的功能。

为了找到参与机体抗病毒感染的胆固醇代谢酶或相应的天然产物,他们利用乙肝病毒感染肝癌病人样本、多种类型病毒感染的小鼠肝组织或巨噬细胞进行筛选,发现不论应对DNA病毒,还是RNA病毒的感染,7脱氢胆固醇还原酶(DHCR7)的表达量均显著降低。DHCR7是将7-脱氢胆固醇(7-DHC)转化成胆固醇的关键酶,DHCR7突变的病人表现智力发育障碍【6】,但是并不清楚DHCR7如何调控先天免疫抗病毒感染的功能。通过构建条件性敲除DHCR7的小鼠、敲减或敲除DHCR7的巨噬细胞、利用小分子抑制剂阻断DHCR7的酶活等策略,都能显著增强病毒感染介导的IFNβ产生。并且,病毒感染的肝脏组织、DHCR7缺失或其抑制子处理的巨噬细胞升高7-DHC的含量,而且外加天然产物7-DHC也能促进巨噬细胞抗感染的功能。有意思的是,用于治疗乳腺癌的化疗药物他莫昔芬(Tamoxifen)曾被FDA批准能抑制DHCR7酶活,本研究发现他莫昔芬具有抑制水疱性口炎病毒(VSV)和寨卡病毒 (ZIKV)感染的新功能,提示老药新用的可能。利用DHCR7抑制剂AY9944处理小鼠,血清中7-DHC含量显著升高,保护小鼠抵抗致死剂量VSV和流感病毒(H1N1)的感染。这项研究揭示胆固醇中间代谢产物7-DHC和靶向DHCR7的抑制剂均能发挥抗多种病毒感染的功能,这将有助于开发抵御新发或重症病毒感染的新策略。
更进一步的机制探索发现:静息期的巨噬细胞表达很低水平的AKT3,病毒感染促进AKT3的表达,而代谢产物7-DHC能促进PI3K-AKT3的活化。此外,作为蛋白激酶的AKT3直接结合IRF3,增强IRF3在丝氨酸385位的磷酸化,进而促进IRF3二聚体形成和向细胞核内转移,最终增强IFNβ产生(下图)。敲除AKT3的小鼠显著降低IFNβ的产生,升高病毒载量,导致更多小鼠死亡。
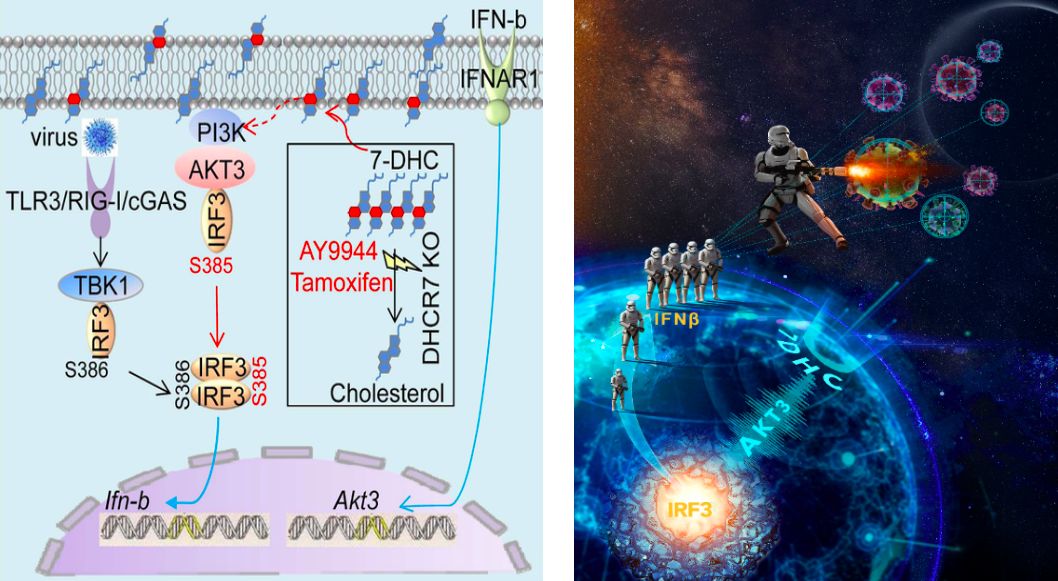
左图:研究的模型示意图;右图:卡通科普图《当外星体入侵地球时,地球表层的预警中心(7-DHC)发射急救信号(AKT3)到达地心指挥部(IRF3),使得地球卫士(IFNβ)大量并迅速集合,运输到宇宙中抵抗外星体。》
综上所述,靶向胆固醇代谢通路中的7-脱氢胆固醇还原酶(DHCR7)能导致上游产物7脱氢胆固醇积累,通过活化AKT3和IRF3,提高IFNβ和抗病毒功能。这项研究不仅为抵御新发或高致病性病毒的感染提供了新型药物靶点,也为胆固醇代谢重编程调控天然免疫提供了新见解。
据悉,王红艳实验室肖俊博士和李伟芸博士后是本文的共同第一作者,该研究还获得了中国科学院上海营养与健康研究所翟琦巍研究员、中国农业科学院哈尔滨兽医研究所陈化兰院士、南京大学模式动物研究所杨中州研究员等的大力帮助。
原文链接:
https://www.cell.com/immunity/fulltext/S1074-7613(19)30496-0
参考文献
1. York, A.G., Williams, K.J., Argus, J.P., Zhou, Q.D., Brar, G., Vergnes, L., Gray, E.E., Zhen, A., Wu, N.C., Yamada, D.H., et al. (2015). Limiting Cholesterol Biosynthetic Flux Spontaneously Engages Type I IFN Signaling. Cell 163, 1716-1729.
2. Blanc, M., Hsieh, W.Y., Robertson, K.A., Kropp, K.A., Forster, T., Shui, G., Lacaze, P., Watterson, S., Griffiths, S.J., Spann, N.J., et al. (2013). The transcription factor STAT-1 couples macrophage synthesis of 25-hydroxycholesterol to the interferon antiviral response. Immunity 38, 106-118.
3. Li, C., Deng, Y.Q., Wang, S., Ma, F., Aliyari, R., Huang, X.Y., Zhang, N.N., Watanabe, M., Dong, H.L., Liu, P., et al. (2017). 25-Hydroxycholesterol Protects Host against Zika Virus Infection and Its Associated Microcephaly in a Mouse Model. Immunity 46, 446-456.
4. Liu, S.Y., Aliyari, R., Chikere, K., Li, G., Marsden, M.D., Smith, J.K., Pernet, O., Guo, H., Nusbaum, R., Zack, J.A., et al. (2013). Interferon-inducible cholesterol-25-hydroxylase broadly inhibits viral entry by production of 25-hydroxycholesterol. Immunity 38, 92-105.
5. Francis, K.R., Ton, A.N., Xin, Y., O'Halloran, P.E., Wassif, C.A., Malik, N., Williams, I.M., Cluzeau, C.V., Trivedi, N.S., Pavan, W.J., et al. (2016). Modeling Smith-Lemli-Opitz syndrome with induced pluripotent stem cells reveals a causal role for Wnt/beta-catenin defects in neuronal cholesterol synthesis phenotypes. Nature medicine 22, 388-396.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479376&idx=2&sn=d654f014baf2916c060d066fc4a63e92&chksm=84e20c24b3958532e3205772c180d6c42ad3d899bdf8c29edda81efc8cb2048df3ac2628e6d5&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
胆固醇乙酸酯

流言:吃肉会升高胆固醇
胆囊胆固醇性息肉

Cell丨胆固醇和鞘磷脂的“探戈”
高密脂蛋白3-胆固醇
《自然》:西方国家的胆固醇水平在下降,但亚洲的胆固醇水平在上升
胆固醇越低越好?
【健康科普】胆固醇越低越好?提醒:5个方法,或能把胆固醇“控制”住!
胆固醇氯甲酸酯

新研究提出饮酒的安全上限