科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-26
来源:BioArt
责编 | 酶美
编码p53蛋白的TP53基因是人体内最频繁突变的抑癌基因。作为一个转录因子,p53蛋白的转录功能对它的抑癌能力是至关重要的。p53蛋白有着种类繁多的翻译后修饰以调节其功能与活性。其中,p53的C末端结构域(C-terminal domain,CTD)有6个赖氨酸残基的乙酰化修饰,能通过与其它蛋白质的相互作用调节p53转录活性。这些能特异性识别蛋白质赖氨酸乙酰化修饰的蛋白质被称为乙酰化修饰的‘reader’。与这个概念一致的还有乙酰转移酶如p300、CBP等被称为‘writer’,去乙酰化酶如HDACs和Sirtuins则被称作‘eraser’,它们在p53中的功能已被大量的工作鉴定并证实【1,2】。
但是p53乙酰化修饰的reader的身份和功能仍然所知甚少。CREB-binding protein (CBP)是唯一被鉴定的p53 CTD乙酰化reader,SET蛋白可以与未乙酰化的CTD结合,它们分别激活或抑制p53的转录活性【3,4】。然而,它们并不能完全解释p53 CTD乙酰化修饰的生物学功能,因此推测还可能存在其它的reader蛋白。
2019年12月20日,美国托马斯杰斐逊大学杨海峰实验室与德克萨斯大学西南研究中心张青实验室合作在Nature Communications杂志上在线发表了题为PBRM1 acts as a p53 lysine-acetylation reader to suppress renal tumor growth 的研究论文。该文揭示了PBRM1是p53 CTD乙酰化修饰的新reader,PBRM1突变减弱p53转录活性从而促进肾癌发生。

在几乎一半的人类肿瘤中都含有TP53突变。有趣的是,在最常见的肾癌亚型-透明细胞肾细胞癌(clear cell renal carcinoma, ccRCC)中, 仅有约3%的肿瘤含有TP53突变【5】。这提示p53的抑癌功能可能被ccRCC其它基因突变影响从而间接的受到破坏。
PBRM1(Polybromo-1 gene),又称BAF180,是SWI/SNF染色质重构复合物的一部分,在大约40%的ccRCC肿瘤中发生突变【6】。PBRM1得名于它含有6个可以识别结合乙酰化赖氨酸的Bromo结构域(Bromodomains, BDs),目前仅清楚其BD2可以通过识别染色质上H3的第14位赖氨酸乙酰化修饰(H3K14Ac)介导整个SWI/SNF染色质重构复合物进行转录调控【7,8】。
有报道指出,SWI/SNF染色质重构复合物的所有成分在癌症中总体突变率约为20%,仅次于TP53的突变率。而且,在许多癌症类型中,SWI/SNF突变也与TP53突变相互排斥 (mutually exclusive)【9】。功能上,某些SWI/SNF复合物与p53相互作用,而且是p53功能所必需的。已有报道表明由p53介导的人原发性成纤维细胞的复制衰老过程中,PBRM1是必需的【10】。因此,研究者猜测PBRM1可能通过其BDs,识别乙酰化p53并调控p53的转录功能。
首先,研究者在多种癌症细胞系中发现PBRM1与p53结合;特别当细胞被DNA损伤药物处理导致p53激活后,它们的相互作用显著增强。实验还确认p53 C末端(CTD)是PBRM1的主要结合位点。进一步通过共转染已知的p53乙酰化转移酶,发现CBP或p300的共表达能促进PBRM1和p53的结合。实验结果还表明p53 CTD上的赖氨酸残基乙酰化修饰是PBRM1识别的主要位点。基于p53 C端氨基酸序列,研究者合成了一系列乙酰化修饰的多肽并确认p53 382位赖氨酸残基的乙酰化修饰(K382Ac)被PBRM1识别。
下一步,研究者构建了一系列PBRM1截短蛋白,发现PBRM1 BD4的缺失极大地影响PBRM1与p53的结合。而在PBRM1的6个BD结构域中,只有BD4能显著结合p53、p53 CTD多肽和K382Ac多肽。研究者又构建了一系列PBRM1点突变蛋白,包括肾癌来源的BD4点突变蛋白,再次证实BD4结构域对p53 K382Ac的识别至关重要。
在p53研究模式细胞系H1299和HCT116中, PBRM1敲除导致p53下游基因的转录下调。CHIP实验证实PBRM1敲除降低了p53与CDKN1A基因(编码p21蛋白)启动子的结合。同样,在一系列p53野生型的肾癌细胞系中,PBRM1敲低或敲除也可降低了p53转录下游基因的表达。反之,PBRM1回复表达增强了p53的转录活性和p53与CDKN1A基因启动子的结合,而PBRM1 BD4点突变则丧失此功能。
在表型上,PBRM1敲低导致在DNA损伤药物处理时,G1期细胞比例明显下降,S期细胞比例增加。在小鼠模型上,PBRM1的回复表达抑制了肿瘤生长,但是PBRM1 BD4点突变则导致PBRM1的抑制肿瘤功能受损。这些结果同p21、PUMA等p53下游基因表达的结果一致。最后,在肾癌病人样本中,发现了PBRM1表达缺失与p21表达缺失呈正相关,特别是在肾癌早期病人样本中尤其显著。
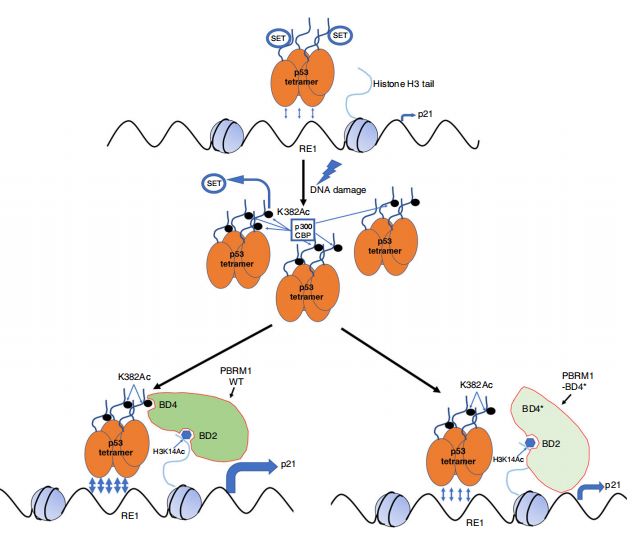
总结来说,此研究发现了PBRM1是一个新的p53 C末端乙酰化修饰的reader,其BD4与p53 K382Ac的识别结合对PBRM1的抑癌作用至关重要。这项研究不光揭示了PBRM1在肾癌中的抑癌机制,也拓宽了人们对p53信号通路与SWI/SNF染色质重构复合物这两大抑癌途径相互作用的认识。此外,该研究也挑战了一些乙酰化修饰与BD识别的传统观点:
不同于传统的15氨基酸左右的多肽,较长的26氨基酸多肽才能在此研究中与PBRM1 BD4结合,提示目前的多肽-BD筛选方法可能存在缺陷;
多个赖氨酸位点的乙酰化并不一定增强结合,有时甚至明显阻止BD与多肽的结合,此结果支持‘histone code’假说并暗示p53 CTD上六个赖氨酸残基上的乙酰化修饰可能有彼此不同的功能;
进一步阐明临近的BD结构能支持主要BD对乙酰化修饰的识别,指出目前单BD研究模式的可能潜在缺陷。
据悉,托马斯杰斐逊大学的蔡维嘉博士是该研究成果的第一作者。耶鲁大学的严钦实验室,托马斯杰斐逊大学的两位合作者蒋巍博士,钟志玖博士,以及天普大学Fox Chase癌症中心的三位合作者Essel Dulaimi, Joseph R. Testa, Robert G. Uzzo 也在该研究中做出了重要贡献。
原文链接:
https://www.nature.com/articles/s41467-019-13608-1
制版人:琪酱
参考文献
1. Kruse, J. P. &Gu, W. Modes of p53 regulation. Cell 137, 609–622 (2009).
2. Brooks, C. L.& Gu, W. The impact of acetylation and deacetylation on the p53 pathway. Protein Cell 2, 456–462 (2011).
3. Mujtaba, S. et al.Structural mechanism of the bromodomain of the coactivator CBP in p53transcriptional activation. Mol. Cell13, 251–263 (2004).
4. Wang, D. et al.Acetylation-regulated interaction between p53 and SET reveals a widespreadregulatory mode. Nature 538, 118–122 (2016).
5. Cancer GenomeAtlas Research, N. Comprehensive molecular characterization of clear cell renalcell carcinoma. Nature 499, 43–49 (2013).
6. Varela, I. et al.Exome sequencing identifies frequent mutation of the SWI/SNF complex gene PBRM1in renal carcinoma. Nature 469, 539–542 (2011).
7. Charlop-Powers,Z., Zeng, L., Zhang, Q. & Zhou, M. M. Structural insights into selectivehistone H3 recognition by the human Polybromo bromodomain 2. Cell Res. 20, 529–538 (2010).
8. Liao,L. et al. Highaffinity binding of H3K14ac through collaboration of bromodomains 2, 4 and 5 iscritical for the molecular and tumor suppressor functions of PBRM1. Molecularoncology 13 , 811-828 (2019).
9. Kadoch, C. et al.Proteomic and bioinformatic analysis of mammalian SWI/SNF complexes identifiesextensive roles in human malignancy. Nat.Genet. 45, 592–601 (2013).
10. Burrows, A. E.,Smogorzewska, A. & Elledge, S. J. Polybromo-associated BRG1-associatedfactor components BRD7 and BAF180 are critical regulators of p53 required forinduction of replicative senescence. Proc.Natl Acad. Sci. USA 107,14280–14285 (2010).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479416&idx=6&sn=350b1a911f390eb196ab2ecb34675bcb&chksm=84e20c0cb395851aa0f2a55f59cf8ffee2c73a9bed1bc4202935fcdc2471c08b1345f59d5d08&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
p53基因检测
上海交通大学程金科团队等控揭示调控制线粒体蛋白乙酰化新通路



绦虫药物能抗癌!西兰花抗癌新机制!还有哪些你不知道的抗癌新疗法?

Nature:颠覆性发现,肠道菌群将突变p53基因从促癌基因转变为抑癌基因

AREB1通过调节组蛋白乙酰化介导杨树干旱响应
刘颖/李川昀合作发现组蛋白去乙酰化酶调控线粒体应激反应

北大刘颖/李川昀揭示组蛋白去乙酰化酶调控线粒体应激反应和寿命

Cell | 跨代传递的组蛋白H4K16乙酰化决定未来基因激活

组蛋白乙酰化酶HAC1/5是MEDIATOR复合物的植物特异亚基研究取得进展

肠道环境“赐予”p53基因的两面派作用:抗癌or促癌