科技工作者之家
加好友
科技工作者之家 2021-08-21
核因子-κB (NF-κB) 信号的组成性激活在结直肠癌 (CRC) 的发展和进展中起关键作用。然而,NF-κB 信号过度激活的潜在机制在很大程度上仍然未知。
2021年8月19日,中山大学兰平及Wu Xianrui共同通讯在Molecular Cancer (IF=27.40)在线发表题为“A novel NF-κB regulator encoded by circPLCE1 inhibits colorectal carcinoma progression by promoting RPS3 ubiquitin-dependent degradation”的研究论文,该研究使用高通量 RNA 测序来鉴定正常人肠上皮细胞系和 CRC 细胞系之间差异表达的环状 RNA (circRNA)。使用 LC-MS 对 circPLCE1 编码的蛋白质进行鉴定。新蛋白质的功能在体外和体内通过功能获得或丧失测定得到验证。
该研究发现一种由环状 RNA circPLCE1 编码的新型蛋白质 circPLCE1-411 被鉴定为 CRC NF-κB 激活的关键参与者。从机制上讲,circPLCE1-411 通过直接结合 HSP90α/RPS3 复合物促进关键 NF-κB 调节因子 RPS3 的泛素依赖性降解,以促进 RPS3 从复合物中解离,从而减少 CRC 细胞中的 NF-κB 核易位。在功能上,circPLCE1 抑制 CRC 细胞以及患者来源的异种移植和原位异种移植肿瘤模型中的肿瘤增殖和转移。临床上,circPLCE1 在 CRC 组织中下调,并且与晚期临床分期和较差的存活率相关。总之,该研究发现circPLCE1可以破坏 NF-κB 核易位,并作为一种新的、有前景的治疗靶点和预后标志物。
另外,2021年4月9日,中山大学兰平及Wu Xianrui共同通讯在Signal Transduction and Targeted Therapy (IF=13.49)在线发表题为“Mutant KRAS triggers functional reprogramming of tumor-associated macrophages in colorectal cancer”的研究论文,该研究证明了KRAS的细胞外在作用,其中KRAS通过对肿瘤相关巨噬细胞(TAMs)进行功能性重编程而与肿瘤微环境结合。在人类CRC标本中,突变体KRAS与TAM的存在呈正相关。肿瘤细胞中突变激活的KRAS通过肿瘤衍生的CSF2和乳酸的联合作用将巨噬细胞重编程为TAM样表型。反过来,显示出KRAS重编程的巨噬细胞不仅促进肿瘤进展,而且诱导肿瘤细胞对西妥昔单抗治疗产生耐药性。从机制上讲,KRAS通过稳定低氧诱导因子-1α(HIF-1α)来驱动肿瘤细胞中CSF2和乳酸的产生,HIF-1α是一种控制CSF2和糖酵解基因表达的转录因子。突变体KRAS增加了活性氧的产生,活性氧是脯氨酰羟化酶活性的抑制剂,可降低HIF-1α的羟基化,从而增强HIF-1α的稳定性。这种细胞外源性机制授予KRAS在改造允许的微环境以促进肿瘤恶性作用中的关键作用,并且可能为针对突变KRAS肿瘤的潜在治疗防御策略提供新的见解。 核因子-κB (NF-κB) 是最具多效性的转录因子之一。大量研究表明,NF-κB 信号通路的组成型激活在人类癌症的发生和发展中起着重要作用。此外,肿瘤中NF-κB 的过度激活被证明与晚期肿瘤分期以及较差的总生存期有关 。然而,NF-κB 信号通路的组成型激活机制仍未完全了解。
核因子-κB (NF-κB) 是最具多效性的转录因子之一。大量研究表明,NF-κB 信号通路的组成型激活在人类癌症的发生和发展中起着重要作用。此外,肿瘤中NF-κB 的过度激活被证明与晚期肿瘤分期以及较差的总生存期有关 。然而,NF-κB 信号通路的组成型激活机制仍未完全了解。
结直肠癌 (CRC) 是世界范围内常见的致命疾病。由于远处转移治疗方法的局限性,它仍占结直肠癌相关死亡的 ~ 90%。因此,迫切需要探索驱动肿瘤发生和转移的因素,以提供更好的治疗选择并改善结直肠癌患者的肿瘤学结果。NF-κB 的组成性激活被证明与晚期肿瘤分期和 CRC 患者的不良生存相关。在 CRC 的发展中,据报道 NF-κB 从早期腺瘤到浸润性癌症和转移都起着至关重要的作用。NF-κB 的异常激活增加了 Wnt 信号通路并诱导了非干细胞的去分化,这些细胞获得了启动肿瘤发生的肿瘤起始能力。此外,NF-κB 通过增强上皮间质转化、促进自主生长信号传导和重塑肿瘤微环境来促进 CRC 进展 。然而,在 CRC 中过度激活 NF-κB 信号通路的潜在机制仍然未知。
环状 RNA (circRNA) 是一组内源性非编码 RNA,通过反剪接反应进行环化 。鉴于其稳定性和进化保守性,circRNA 可以作为各种细胞生物学和病理过程的重要调节因子。迄今为止,大多数关于 circRNA 的研究都集中在它们作为 microRNA/蛋白质海绵的功能上。由于不存在开放阅读框(ORF),因此假设 circRNA 不可翻译。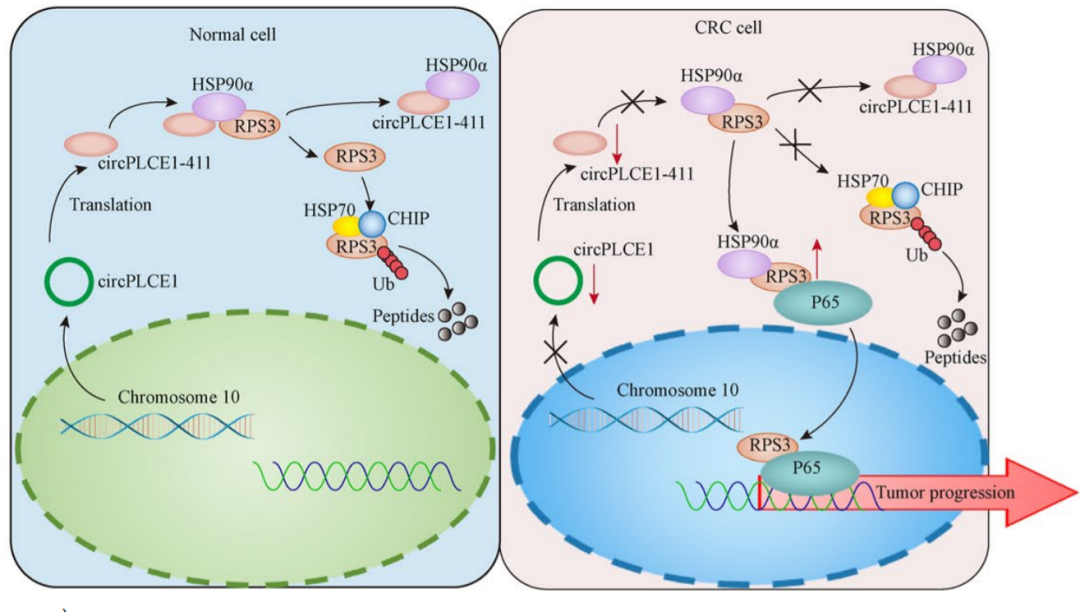 然而,最近的研究表明,circRNA 确实可以编码蛋白质。circ-E-Cad 能够编码 C-E-Cad,通过激活 EGFR-STAT3 信号通路促进胶质母细胞瘤的致瘤性 。在结肠癌中,circRNAs,如 circPPP1R12A 和 circFNDC3B 也被证明通过编码新的蛋白质来调节肿瘤进展。关于 circRNA 与 CRC 中 NF-κB 信号通路的关系,circGLIS2 通过 miR-671 海绵机制维持 NF-κB 信号通路的异常激活状态。然而,目前尚不清楚是否存在编码蛋白质的 circRNA 参与 NF-κB 信号的调节。
然而,最近的研究表明,circRNA 确实可以编码蛋白质。circ-E-Cad 能够编码 C-E-Cad,通过激活 EGFR-STAT3 信号通路促进胶质母细胞瘤的致瘤性 。在结肠癌中,circRNAs,如 circPPP1R12A 和 circFNDC3B 也被证明通过编码新的蛋白质来调节肿瘤进展。关于 circRNA 与 CRC 中 NF-κB 信号通路的关系,circGLIS2 通过 miR-671 海绵机制维持 NF-κB 信号通路的异常激活状态。然而,目前尚不清楚是否存在编码蛋白质的 circRNA 参与 NF-κB 信号的调节。
在这项研究中,发现 circRNA circPLCE1 在 CRC 组织中下调,并且与临床分期和存活率相关。此外,circPLCE1在体外和体内促进CRC增殖和转移。从机制上讲,circPLCE1 编码了一种新的蛋白质 circPLCE1-411,通过直接结合 HSP90α/RPS3 复合物来促进关键 NF-κB 调节因子 RPS3 的泛素依赖性降解,从而促进 RPS3 从复合物中解离并减少 NF-κB核易位。
来源:iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247533747&idx=3&sn=fb49d8054bddd73c5d9a2996b2579d24
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
《细胞》发文!阿片类药物迎来重大突破

肿瘤干细胞研究取得进展
从单个细胞入手的肿瘤研究

发光纳米颗粒可以更快更精准地检测癌症
肿瘤竟把免疫细胞关进“小黑屋”


胸腔积液肿瘤细胞学检查

CGCS2021 | 向阳教授领衔,共谈妊娠滋养细胞肿瘤诊治规范——妊娠滋养细胞肿瘤专场
从健康细胞到癌细胞,或许只需要几个突变

CCS Chemistry | Amyloid β诱导肿瘤细胞端粒功能紊乱
胸腔积液肿瘤细胞学检查