科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-29
来源:BioArt
在阿尔茨海默症和一些其他神经退行性疾病患者的脑中,存在被称为amyloid的蛋白斑块,这种淀粉样的蛋白斑块是由一些错误折叠的蛋白组成。长期以来,人们一直认为这些淀粉样蛋白是破坏记忆和运动神经元功能的罪魁祸首。但淀粉样蛋白杀死细胞的调控机制一直不清楚。
近日,美国国立卫生研究院(NIH)癌症研究所代承凯课题组在Science Advances杂志上发表文章HSF1 physically neutralizes amyloid oligomers to empower overgrowth and bestow neuroprotection ,研究发现了HSF-1能直接阻断淀粉样蛋白多聚化,从而防止淀粉样蛋白杀死细胞的机制。

热休克/蛋白热激反应(PSR)是一种进化上保守的细胞保护机制,在肿瘤发生过程中起关键的作用。PSR对于蛋白质或蛋白质组稳态以及胁迫下的细胞存活至关重要。在受到环境侵害时,细胞发生热激反应,细胞中的热激蛋白(HSP)将显著增加。HSP作为分子伴侣通过促进蛋白质折叠、运输、泛素化和蛋白酶体降解来保护蛋白质组,防止错误折叠和聚集。细胞发生热激反应时,热激因子1(HSF1)是调节热激蛋白转录的主要因子。运用多种癌症的小鼠模型,研究者发现HSF1是一种强大的促癌因子,并在2015年他们的Cell文章中指出抑制HSF1的同时抑制蛋白酶体会产生淀粉样蛋白。同时,这些淀粉样蛋白具有杀死肿瘤细胞的能力。淀粉样蛋白杀死肿瘤细胞的分子机制也未曾探究。
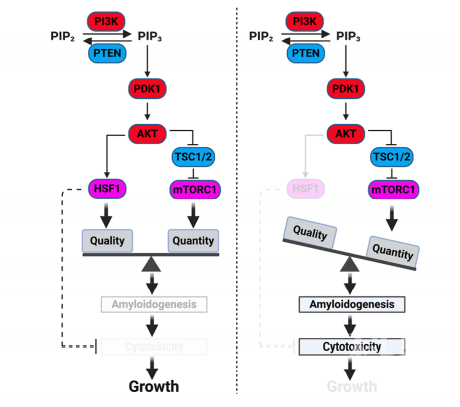
为了研究淀粉样蛋白如何抑制肿瘤生长,研究者构建了一个磷脂酰肌醇3-激酶(PI3K)过表达的巨脑小鼠模型,并发现HSF1 在这个模型中起至关重要的作用。当没有HSF1时,小鼠的巨脑表型得以缓解,存活时间也更长。研究发现在没有HSF1时,由PI3K过表达产生的淀粉样蛋白会引起小鼠脑部细胞的大规模死亡,从而减轻小鼠巨脑的性状。研究人员进一步发现,在没有HSF1时,淀粉样蛋白低聚物(AOs)与热激蛋白60(HSP60)相互作用,HSP60可溶性降低,形成不可溶性蛋白聚合体,进而导致线粒体蛋白质组的紊乱,从而引起细胞的凋亡。而当HSF1正常存在时,HSF1可以不依赖于其转录活性,代替HSP60直接与可溶性淀粉样蛋白低聚物(AOs)结合,以此维持线粒体的蛋白质组稳定,并增强细胞的生存率。
研究还发现在阿尔茨海默氏症中也存在着相同的机制。研究者在体外培养神经细胞中过表达Ab短肽以形成淀粉样蛋白,构建了一个体外的阿尔茨海默氏症细胞培养模型。在这个模型中,过表达没有转录活性的HSF1突变体将抑制HSP60与淀粉样蛋白的相互作用,同时阻止淀粉样蛋白杀死细胞。同时,研究者对阿尔茨海默氏症患者的大脑切片分析也发现了HSP60与淀粉样蛋白相互作用这一现象。由此说明,在神经退行性疾病中,HSF1不但可以阻止淀粉样蛋白的生成,还可以通过竞争性的与淀粉样蛋白结合,以防止HSP60可溶性降低,从而避免了线粒体蛋白质组的紊乱以及最终线粒体损伤引起的细胞凋亡。因此,这些研究工作表明淀粉样蛋白的增加是限制细胞过度生长和维持组织稳定的关键,是一种新兴的肿瘤抑制机制。HSF1作为抗淀粉样蛋白因子,可因此促进癌症,也可能抑制神经退行性疾病的发生。
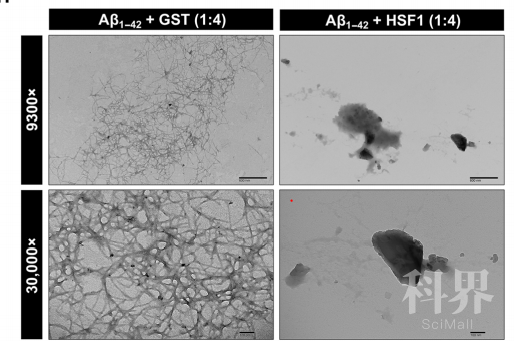
这篇论文利用由过表达的PI3K信号驱动的巨脑小鼠模型揭示了淀粉样蛋白杀死细胞的分子机制。HSF1缺失会加剧淀粉样蛋白生成并引发凋亡,从而抵抗细胞过度生长。出乎意料的是,HSF1可竞争性的结合AOs以保护HSP60免受AOs的直接攻击,避免HSP60的不稳定、线粒体蛋白质组的崩溃以及最终导致的细胞凋亡。而在阿尔茨海默氏病中相同的分子机制则造成了神经细胞死亡和神经退行性疾病。这些发现表明淀粉样蛋白的生成可能是限制细胞不受控制生长的检查机制,这与其新兴的肿瘤抑制功能是一致的。HSF1通过充当抗淀粉样蛋白因子,促进过度生长综合症和癌症,但可能抑制神经变性疾病。
总的来说,该论文环环相扣,层层递进利用最初的巨脑小鼠模型、体外的阿尔茨海默氏症细胞模型和阿尔茨海默氏症脑切片详尽的研究了淀粉样蛋白杀死细胞的分子机制。
汤子建博士后为该论文第一作者,代承凯研究员为通讯作者。
原文链接:
https://advances.sciencemag.org/content/advances/6/46/eabc6871.full.pdf
参考文献
1. Tang Z, Su K, Xu M, Dai C. HSF1 physically neutralizes amyloid oligomers to empower overgrowth and bestow neuroprotection. Science Advances. 2020.
1. Tang Z, Dai S, He Y, Doty RA, Shultz LD, Sampson SB, Dai C. MEK Guards Proteome Stability and Inhibits Tumor-Suppressive Amyloidogenesis via HSF1. Cell. 2015, 160(4):729-44.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652511812&idx=7&sn=d8fb407cb6bb26d6e4c09f796dcc5a9d
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人体细胞内存在“铁路”系统,能自动优化结构
蛋白质分离中可逆淀粉样蛋白形成的生物学功能
功能性淀粉样蛋白的理性设计迎来新趋势
血清淀粉样蛋白A

淀粉样蛋白同样存在植物中,并帮助种子保存更长时间
《细胞》发文!阿片类药物迎来重大突破

Cell丨自噬如何减少脑中异常β淀粉样蛋白沉积?

学术造假必遭严惩,为何仍不断有人冒险

人工细胞与生物细胞首次实现成功融合与协作
《德国应化》反应性共轭聚合物用于抑制淀粉样蛋白聚集