科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-07
来源:BioArt
原标题:Science:童亮课题组等揭示histone pre-mRNA 3'端加工的分子机制
在多细胞生物中,几乎所有的mRNA前体(pre-mRNA)的3’端加工都是通过核酸内切酶在特异性位点的切割和在该位点添加poly(A) 尾两个步骤完成的。但是复制依赖型组蛋白(replication-dependent histone) pre-mRNA是个特殊的类别,这些蛋白是核小体(nucleosome)的重要组成部分,仅在细胞周期的S期快速大量表达以包裹新复制合成的DNA,与经典的以poly(A) 结尾的mRNA不同,组蛋白 mRNA是以一段保守的茎-环结构(stem-loop)作为其成熟mRNA的3’末端【1】。两者采用不同的3’端加工机器,然而,进化中负责切割两种pre-mRNA的蛋白质模块却是相同的。该模块由核酸内切酶CPSF73,其同源蛋白CPSF100,脚手架蛋白Symplekin和切割促进因子CstF64组成,该模块在组蛋白通路中被称作HCC (histone pre-mRNA cleavage complex),在经典poly(A) 通路中被称作mCF (mammalian cleavage factor)。核酸内切酶的活性在体内需要受到精确的调控,因此HCC/mCF模块在两条通路中均需要多个辅助蛋白的参与来帮助其识别正确的pre-mRNA底物以及诱发核酸内切酶CPSF73的激活。但至今对于HCC/mCF 如何催化切割pre-mRNA以及与辅助蛋白之间如何互作的分子机制依然知之甚少。
美国哥伦比亚大学童亮研究组曾在2006年解析了核酸内切酶CPSF73 闭合状态的晶体结构【2】,并且多年来一直从事对 pre-mRNA 不同类型3’端加工机器的结构生物学研究。近年,童亮研究组与洛克菲勒大学Thomas Walz研究组合作利用冷冻电镜技术(Cryo-EM) 阐明了人类pre-mRNA 3’端加工经典通路中poly(A) 信号AAUAAA的识别机制【3】和重要蛋白模块的组装机制【4】(详见BioArt报道:Mol Cell | 童亮课题组等揭示pre-mRNA的3’端加工机制)。研究发现mCF/HCC自身结构高度动态,推测mCF 必须进行一系列的结构重排,才能实现对RNA的切割。
为了揭开mCF/HCC激活机制的谜题, 2020年2月7日,童亮研究组, Thomas Walz研究组和北卡罗来纳大学教堂山分校的William Marzluff研究组合作在Science发表论文,题为:Structure of an active human histone pre-mRNA 3'-end processing machinery。研究人员利用13个重组蛋白和两条RNA重构出具有切割活性的人类组蛋白pre-mRNA 3’端加工机器,并且解析了催化状态下复合物的冷冻电镜结构(图1)。结构揭示出不同蛋白之间精细地协同互作,从而实现核酸内切酶CPSF73精确切割RNA的分子机制,很好的解释了大量生化和功能实验中的数据,并且对于经典通路pre-mRNA和snRNA 3’端加工有重要的提示作用。


图1人类组蛋白pre-mRNA 3’端加工机器的结构
人类组蛋白pre-mRNA 3’端加工机器由HCC,U7 snRNP (small nuclear ribonucleoproteins), FLASH和茎环结构结合蛋白SLBP (stem-loop binding protein)组成,组蛋白pre-mRNA作为其底物(图1)。3’端加工位点位于保守的茎环结构SL(stem-loop)和组蛋白pre-mRNA下游序列元件HDE (histone down stream element)之间。SLBP蛋白可以特异性识别该茎环结构【5】。
在样品的制作过程中,研究人员通过低温来减慢3’端加工的进程,并且收集大量冷冻电镜数据,仔细分类,从中成功捕捉到pre-mRNA位于核酸内切酶CPSF73活性位点,准备被切割的状态,即核心部分(core) 3.2 Å的冷冻电镜结构(图1)。结构解释了3’端加工位点具有腺嘌呤特异性的原因,并阐明CPSF73切割RNA的分子机制。
结构显示,HDE与U7 snRNA形成RNA双螺旋,HCC中Symplekin N端结构域、CPSF100的β-CASP结构域和CPSF73的metallo-β-lactamase结构域从三个侧面对该双螺旋识别,使原本处于高度动态的HCC发生结构重排(图2)。研究人员指出该识别是HCC和CPSF73激活的关键性起始步骤,
值得注意的是,与闭合状态的CPSF73相比,其β-CASP结构域相对于 metallo-β-lactamase结构域发生了17o的旋转,从而产生可以容纳单链RNA的“狭缝”,实现切割。结构对比发现 U7 snRNP中的Lsm10,其保守的N和C端与关闭状态的CPSF73 β-CASP结构域存在空间位阻,且Lsm10的C端部分位于“狭缝”的边缘,与底物有相互作用(图2)。研究人员推测Lsm10是诱发CPSF73激活的关键蛋白。HCC识别HDE-U7双螺旋发生结构重排后,迫使CPSF73与Lsm10靠近,Lsm10引起CPSF73结构域的重排。
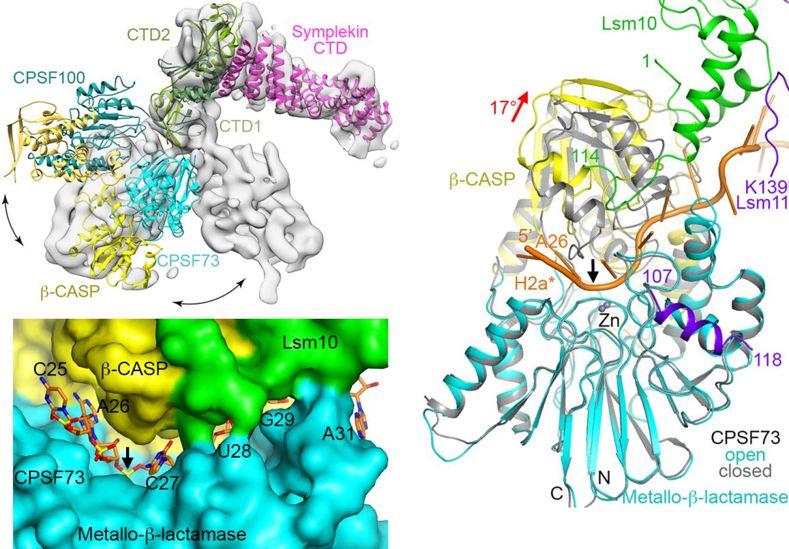
图2 HCC和CPSF73 的活性状态
在核心部分 3.2 Å的结构中,研究人员发现并没有属于FLASH和SLBP蛋白的密度图,但功能实验表明这两个蛋白的缺失会影响组蛋白pre-mRNA 3’端加工机器的激活,所以研究人员对该核心部分结构进一步分类,解得复合物整体4.1Å的冷冻电镜结构(图1)。结构结合生化实验显示FLASH形成长80Å的coiled coil结构【6】,连接HCC中symplekin C端结构域、SLBP-茎环结构和U7 snRNP中的Lsm11,帮助协调拉近各个组份,进而帮助底物成功进入CPSF73激活产生的“狭缝”中。
人类组蛋白pre-mRNA 3’端加工机器催化状态的结构揭示了其组装和激活机制。结合生化数据,研究人员提出了组蛋白pre-mRNA 加工循环(图3):U7 snRNP(步骤I)结合FLASH(II),随后招募HCC(III),在结合底物pre-mRNA之前,整个加工机器高度动态,伴随着对pre-mRNA的识别,HCC和CPSF73激活(IV,即本文结构),切割后(V),5’端产物释放,3’端产物被核酸外切酶降解,蛋白复合物进入下一个切割循环。

图3组蛋白pre-mRNA 加工循环
美国哥伦比亚大学童亮研究组的孙亚东博士和洛克菲勒大学Thomas Walz研究组的张一小博士为该论文的共同第一作者。
原文链接:
https://science.sciencemag.org/content/367/6478/700
参考文献
1, Dominski Z., Marzluff WF. (2007) Formation of the 3' end of histonemRNA: getting closer to the end. Gene 396, 373-390.
2, Mandel, C.R., Kaneko, S., Zhang, H., Gebauer, D., Vethantham,V., Manley, J.L., and Tong, L. (2006). Polyadenylation factor CPSF-73 is thepre-mRNA 3'-end-processing endonuclease. Nature 444, 953-956.
3, Sun, Y., Zhang, Y.,Hamilton, K., Manley, JL, Shi, Y., Walz, T., and Tong, L. (2018). Molecularbasis for the recognition of the human AAUAAA polyadenylation signal. Proc NatlAcad Sci USA 115, E1419-E1428. (Epub Dec. 5, (2017))
4, Zhang Y, Sun Y, Shi Y,Walz T, Tong L. (2019) Structuralinsights into the human pre-mRNA 3'-end processing machinery. Molecular Cell. 2019 Nov 25 (Epub ahead of print)
5, Tan D., Marzluff WF.,Dominski Z., Tong L., Structure of histone mRNA stem-loop, humanstem-loop binding protein, and 3'hExo ternary complex. Science 339, 318-321(2013).
6, Aik WS et al., TheN-terminal domains of FLASH and Lsm11 form a 2:1 heterotrimer for histonepre-mRNA 3'-end processing. PLoS One 12, e0186034 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652480697&idx=1&sn=f7c03a90bb187cc446eca7b9fb1c4b51&chksm=84e2370db395be1baafdabae36bc4d333d147348170aed3b8563d4d9a40c01ef7edf9cfb7a06&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

上海交大方玉达课题组揭示组蛋白变体H2A.Z精细调控生长素信号的分子机制

NAR:李海涛组首次报道组蛋白苯甲酰化阅读器并阐释分子识别机制
Mol Cell | 北大罗建沅组揭示细胞应激调控新通路

揭示减数分裂细胞中组蛋白去甲基化酶底物特异性及调控染色质浓缩的分子机制

揭示核小体结构对组蛋白修饰酶复合物的酶活调控及其分子机制

两篇science背靠背,新的研究热点或将开启
蛋白质设施用户揭示组蛋白分子伴侣OsChz1调控染色质结构的分子机制
Nature : 刘扬/周钶达等揭示组蛋白分子伴侣FACT与亚核小体作用的机制
董爱武和沈文辉团队合作揭示组蛋白分子伴侣OsChz1调控染色质结构的分子机制
蛋白质设施用户揭示植物组蛋白分子伴侣识别组蛋白的结构基础