科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-23
来源:BioArt
肠道微生物是宿主代谢、免疫以及神经内分泌等途径的关键调控因素,与肥胖、Ⅱ型糖尿病、心血管疾病、非酒精性脂肪肝、癌症以及抗肿瘤治疗反应等有着密切联系【1-4】。尽管已有研究探索了微生物群组在长寿人群中的特征,然而肠道微生物在加速老化症候群中发挥的作用仍知之甚少。
2019年7月22日,来自西班牙奥维耶多大学的Carlos López-Otín教授团队在Nature Medicine发表题为Healthspan and lifespan extension by fecal microbiota transplantation into progeroid mice的文章,以Hutchinson–Gilford早衰症(HGPS)小鼠模型、HGPS和Nestor–Guillermo早衰症(NGPS)患者以及百岁老人为对象,研究了不同类群的肠道微生物特征,发现小鼠早衰症模型和早衰症患者的肠道微生物失调,野生型供体的粪菌移植(Fecal Microbiota Transplantation, FMT)能够延缓早衰受体的加速衰老表型并延长寿命,肠道菌群中Akkermansia属具有有益功效,经口灌胃疣微菌门Akkermansia muciniphila能够延长早衰小鼠的寿命。

为探究早衰症与肠道微生物的相关性,作者分别对3个年龄阶段(包括1月、4月和22月,分别简称1mo、4mo和22mo)的野生型(Wild Type, WT)和HGPS小鼠模型LmnaG609G/G609G进行肠道宏基因组分析,比较发现小鼠组内菌群的多样性与丰富性均无差异,而LmnaG609G/G609G 4mo小鼠表现出组间差异聚类。随后,作者用线性判别分析(linear discriminant analysis effect size, LEfSe)的方法对不同分组条件小鼠的肠道细菌类群百分比进行估算,并通过qPCR验证了LmnaG609G/G609G小鼠中Escherichia和Akkermansia的变化。WT 22mo小鼠的少部分肠道微生物表现出失调趋势,唯一显著的变化是Rikenella减少,这与LmnaG609G/G609G 4mo小鼠的组内分析一致。LEfSe分析微生物群组改变在早衰小鼠中的功能,发现致病性细菌相关的KEGG通路发生上调,多种代谢途径发生差异富集。随后,作者利用另外一种早衰小鼠模型Zmpste24-/-,确认了肠道失调与早衰症的关联。
为探究肠道失调是否存在于人类早衰症中,作者从4个患HGPS的儿童和1个患NGPS的儿童以及他们健康的兄弟姐妹和母亲获得粪便样品,发现早衰患者与其对照相比alpha-diversity与beta-diversity无区别。不同家庭组之间样品比较,发现在定量和定性水平存在差别聚类,这与先前的研究一致【5, 6】,说明了环境对肠道菌群的影响大于病理条件产生的影响。然而,在每一个被研究的家庭中,早衰症患者的肠道菌群与他们健康的兄弟姐妹有着不同的特征。LEfSe分析表明早衰患者肠道内的Ruminococcaceae科的Gemmiger减少,Erysipelotrichaceae以及Lachnospiraceae科的梭菌属Clostridium富集。
鉴于在小鼠和早衰症患者中观察到的肠道微生物群变化,作者设想寿命较长的个体 (即百岁老人) 可能拥有有益于健康的微生物群。在对一组百岁老人以及健康对照进行宏基因组分析后,发现百岁老人的alpha-diversity以及细菌丰度均较低,在定量和定性水平beta-diversity指数存在差别聚类,表明百岁老人有着不同的微生物群落结构。LEfSe分析表明百岁老人肠道中存在较少的Betaproteobacteria以及较多的Synergistia和Verrucomicrobiae。这些结果与之前报道的百岁老人中Akkermansia和Christensenellaceae丰度上升,Roseburia丰度降低的研究结果一致。
为探究肠道微生物群的变化是否伴随着HGPS小鼠的衰老加速,作者在四组小鼠中进行粪菌移植(Fecal Microbiota Transplantation, FMT),以野生型对照小鼠作为微生物群供体,LmnaG609G/G609G小鼠作为受体,同时也将较大月龄的LmnaG609G/G609G小鼠肠道微生物(oG609Gmic)群移植至较小月龄的LmnaG609G/G609G小鼠,即植入更恶化表型的早衰小鼠。野生型小鼠肠道微生物(WTmic)移植至LmnaG609G/G609G小鼠(LmnaG609G/G609G-WTmic)后,移植小鼠表现出体重和体温下降的延迟,且未发生表型依赖性的低血糖,肾血管周围纤维化程度也出现减轻,此外,肠道炎症标志物的增加有所恢复。oG609Gmic移植至LmnaG609G/G609G小鼠后(LmnaG609G/G609G-oG609G),一些标志物的表达出现下调,证明FMT本身可能是有益的。LmnaG609G/G609G野生型小鼠的寿命延长,生存率上升,而LmnaG609G/G609G-oG609Gmic小鼠的寿命和生存率均降低。最后,为了评估类早衰菌群的潜在致病性,作者还将年龄较大的LmnaG609G/G609G供体FMT植入WT小鼠 (WT- og609gmic) 中,通过比较各组的宏基因组表达谱,验证肠道定殖的有效性。结果作者并未在WT-oG609Gmic小鼠中发现早衰相关特征,但这种做法导致代谢稳态发生了变化,包括体重增加,葡萄糖水平上升,O2消耗和CO2产量下降以及能源消耗降低。
为验证上述结果,作者将正常小鼠的微生物移植到Zmpste24-/-小鼠体内,发现移植后小鼠表现出较不明显的颈胸前凸畸形、体型增大以及梳毛行为,高血糖症状也得到了缓解。与移植正常小鼠微生物的小鼠类似,该小鼠生存率上升,寿命增加。
在人类和小鼠的肠道微生物宏基因组分析中均获得一致结果,即A. muciniphila在LmnaG609G/G609G 4mo小鼠中丰度降低,在百岁老人样本中增加。因为这种细菌在其他模型中发挥了有益的作用【7, 8】,作者将A. muciniphila经口灌胃LmnaG609G/G609G小鼠,发现小鼠寿命延长,表明这种菌对衰老加速具有延缓作用。与先前研究结果一致,补充A. muciniphila能够诱导回肠表达Reg3g,有利于肠粘膜层的增厚。并且肠道三叶肽因子Tff3表达增加,能够促进粘膜层的愈合与修复。
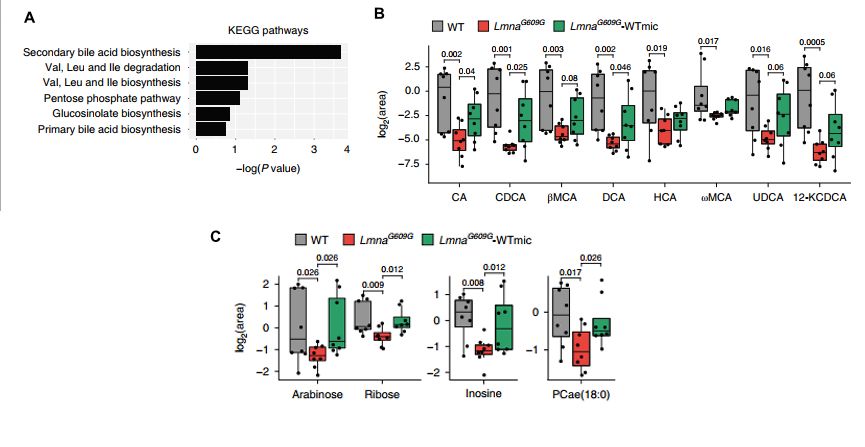
图 1
最后,为探究FMT延长LmnaG609G/G609G小鼠寿命的潜在机制,作者对WT、LmnaG609G/G609G和LmnaG609G/G609G-WTmic小鼠回肠内容物进行了代谢组学分析,发现次生胆汁酸生物合成通路中代谢物富集(图1a)。与WT小鼠相比,LmnaG609G/G609G小鼠胆汁酸减少,更进一步研究发现其回肠中单糖阿拉伯糖和核糖、核苷肌苷和醚磷脂PCae(18:0)含量降低,这些在移植WTmic后的小鼠中均得到恢复(图1b, c,图2)。

图 2
FMT能够调节人类和小鼠的肥胖和新陈代谢,缓解患者的代谢综合征,对于耐受性免疫检查点抑制剂相关结肠炎以及Clostridium difficile的反复感染均有治疗效果【9, 10】。本研究表明,对肠道微生物进行干预能够促进健康并延长寿命。A. muciniphila移植可延长早衰症患者的寿命,从而扩展了先前关于Akkermansia spp. 促进哺乳动物以及老龄小鼠健康状态的研究【11】。以往的研究表明,FMT治疗艰难梭菌C. difficile复发性感染依赖于胆汁酸代谢的重建,而抗生素导致的微生物群减少也抑制了次级胆汁酸库,而重要的是,次生胆汁酸是由肠道微生物群产生的,并与Akkermansia水平密切相关。胆汁酸能调节代谢和抗炎信号,其在LmnaG609G/G609G mice中减少,通过FMT恢复次级胆汁酸和其他代谢物(阿拉伯糖、核糖、肌苷)水平,有助于改善早衰小鼠的健康状态并延长其寿命。
在未来的工作中,进一步确定一些在早衰症发生中发挥重要作用的肠道菌种类及其代谢物,并明确利用FMT改善健康状态和延长寿命的功能机制及其适用性,具有重要的理论和临床意义。
原文链接:
https://doi.org/10.1038/s41591-019-0504-5
参考文献
1. Koeth, R. A. et al. Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat. Med. 19, 576–585 (2013).
2. Loomba, R. et al. Gut microbiome-based metagenomic signature for non-invasive detection of advanced fibrosis in human nonalcoholic fatty liver disease. Cell Metab. 25, 1054–1062 (2017).
3. Qin, J. et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 490, 55–60 (2012).
4. Zitvogel, L., Daillere, R., Roberti, M. P., Routy, B. & Kroemer, G. Anticancer effects of the microbiome and its products. Nat. Rev. Microbiol. 15, 465–478 (2017).
5. Rothschild, D. et al. Environment dominates over host genetics in shaping human gut microbiota. Nature 555, 210–215 (2018).
6. Lloyd-Price, J. et al. Strains, functions and dynamics in the expanded Human Microbiome Project. Nature 550, 61–66 (2017).
7. Gopalakrishnan, V. et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 359, 97–103 (2018).
8. Routy, B. et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science 359, 91–97 (2018)
9. Wang, Y. et al. Fecal microbiota transplantation for refractory immune checkpoint inhibitor-associated colitis. Nat. Med. 24, 1804–1808 (2018).
10. van Nood, E. et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N. Engl. J. Med. 368, 407–415 (2013).
11. Bodogai, M. et al. Commensal bacteria contribute to insulin resistance in aging by activating innate B1a cells. Sci. Transl. Med. 10, eaat4271 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472954&idx=7&sn=4ee620b281ce0816448082171a7139ce&chksm=84e215ceb3959cd85fc0145a848916fd4b0abfe8a696de1804f0d0fc122f713e80cd27e7467a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

肠道微生物影响记忆?今日《自然》揭示菌群变化如何改变大脑

我国最大乳酸菌种资源库建成

Nat Comm重大突破,首次报道肠道微生物菌群的宏乙酰化修饰组全景

运动可以改变肠道菌群,并且是有益的
Cell观点 :深刻反思肠道菌群与人类疾病研究,是时候将微生物组研究拉回正轨了
生物学: 咖啡害虫的致命弱点
微生物学: 生命早期的抗生素使用可能会影响发育

《微生物学前沿》:出门晒晒太阳吧!你的肠道菌群会更好 | 肠道君周刊
微生物的胆汁酸代谢物调节宿主肠道特异Treg细胞的稳态

人体肠道菌群与恶性肿瘤:肠道微生物群调节影响化疗药物的疗效和毒性(三)