科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-29
来源:BioArt
撰文 | 小白薯
ATP释放通道蛋白通过介导中枢神经系统中的信号转导途径,在许多生理学功能中扮演着重要的角色【1】,比如调节兴奋性突触强度、长期突触增强、神经元兴奋性等。钙稳态调节蛋白(Calcium homeostasis modulators,CALHM)与最大的阴离子通道、体积调节的阴离子通道(volume-regulated anion channels,VRAC)蛋白,connexins和pannexins一起,作为主要的ATP释放通道蛋白【2-4】。
CALHM是电压门控、Ca2+抑制的非选择性离子通道。作为主要的ATP释放通道,在味觉信号传导和神经元毒性中具有重要作用【5,6】。研究表明,CALHMs在味蕾细胞中大量表达,负责感知甜味、苦味和鲜味等味觉信号【5】。它们通过细胞外钙离子浓度的减少和细胞膜去极化的过程而激活,从而触发神经味觉通路中的信号级联反应。CALHMs在皮层神经元兴奋性中也具有重要作用。此前研究表明,它的功能障碍与神经系统疾病有关。CALHM1的功能失调及其P86L突变体与神经系统疾病有关,例如阿尔茨海默氏病和缺血性脑损伤【6】。有很多小分子可以参与CALHM的功能调节,除Ca2+外,还包括RUR(ruthenium red,钌红)、Gd3+和2-氨基乙氧基二苯硼酸酯(2-APB)等【6,7】。RUR是六价多糖染色剂【8】,它通过未知的分子机制非特异性地抑制许多离子通道。而关于它是如何调节CALHM蛋白及其整体的分子机制尚不清楚。
2019年11月28日,Nature杂志在线了来自美国范安德尔学院(Van Andel Institute)吕魏和杜鹃课题组合作发表的题为The structures and gating mechanism of human calcium homeostasis modulator 2 的研究长文。该课题组通过Cryo-EM技术,解析了人源钙离子稳态调节蛋白2(Calcium homeostasis modulator 2, CALHM2)在无Ca2+活性状态以及钌红(RUR)结合的抑制状态下的结构,分辨率分别为3.3和2.7 Å。该工作揭示了CALHM2的结构和门控机制,为相关生理和药理学研究建立了夯实的基础。

作者通过全细胞电生理数据发现,在没有Ca2+的情况下,人源CALHM2会产生强大的电流。电流没有明显的电压依赖性,但是可以被Ca2+或RUR以电压依赖性方式抑制。为了阐明CALHM2的组装并了解构成通道门控的分子机制,他们使用cryo-EM技术解析了在EDTA(螯合钙离子)或拮抗剂RUR存在下的人源CALHM2通道结构。
最开始作者使用带GFP标签的目的蛋白收集数据,结果仅产生半通道颗粒。二维分类和重构建模显示出可能是GFP标签的模糊尾巴,而三维重构的分辨率也很低。当把GFP切割后的蛋白不仅改善了Cryo-EM图片质量,而且还以约1:1的比例显示了半通道和间隙连接颗粒,这代表了其大约的解离常数(Kd,约18 μmol)。在存在RUR的情况下,仅观察到半通道,而未观察到间隙连接。这些观察结果表明,C末端GFP标签和RUR的结合都可能影响对接位点的构象变化。
最终,作者解析了以EDTA作为半通道(EDTA-CALHM2 hemi)和间隙连接 (EDTA-CALHM2gap) 以及存在RUR(RUR-CALHM2)的情况的CALHM2结构,其分辨率分别为3.3、3.5和2.7Å(图1)。
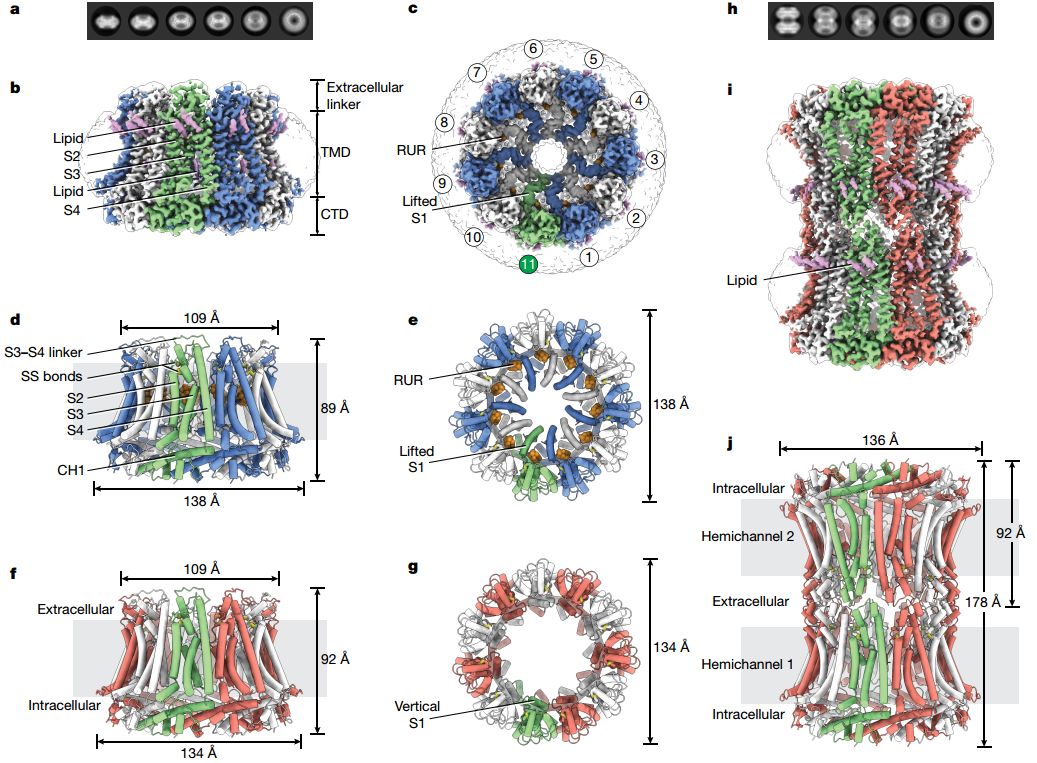
图1. 钌红结合的CALHM2结构。结构分别是(d, e): RUR–CALHM2;(f, g): EDTA–CALHM2hemi; (i, j): EDTA–CALHM2gap
对比不同状态的结构构象,作者提出了一种两段式门控机制(a two-p gating mechanism)。同时,他们还找到了RUR抑制CALHM2的原因,较为详细地阐述了CALHM2通道架构和对称性的原理,以及构成通道抑制的基础。该结构为理解CALHM家族的生理学和药理学机制奠定了坚实的基础。
原文链接:
https://doi.org/10.1038/s41586-019-1781-3
参考文献
1. Abbracchio, M. P., Burnstock, G., Verkhratsky, A. & Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in neurosciences 32, 19-29 (2009).
2. Maeda, S. et al. Structure of the connexin 26 gap junction channel at 3.5 Å resolution. Nature 458, 597 (2009).
3. Myers, J. B. et al. Structure of native lens connexin 46/50 intercellular channels by cryo-EM. Nature 564, 372 (2018).
4. Deneka, D., Sawicka, M., Lam, A. K., Paulino, C. & Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature 558, 254 (2018).
5. Taruno, A. et al. CALHM1 ion channel mediates purinergic neurotransmission of sweet, bitter and umami tastes. Nature 495, 223 (2013).
6. Dreses-Werringloer, U. et al. A polymorphism in CALHM1 influences Ca2+ homeostasis, Aβ levels, and Alzheimer's disease risk. Cell 133, 1149-1161 (2008).
7 Cisneros-Mejorado, A. et al. Blockade and knock-out of CALHM1 channels attenuate ischemic brain damage. Journal of Cerebral Blood Flow & Metabolism 38, 1060-1069 (2018).
8 Martinez-Palomo, A., Braislovsky, C. & Bernhard, W. Ultrastructural modifications of the cell surface and intercellular contacts of some transformed cell strains. Cancer research 29, 925-937 (1969).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478297&idx=6&sn=63952f6377bf628247e212c976df0598&chksm=84e208edb39581fba18ee97edf6b2c4aabeb14ce33a5546900b64c3f0a12cdcad74986813fc6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature论文称,替代新烟碱的杀虫剂仍会伤害蜂群
更好的期刊,更好的科学——中国科技峰会·世界科技期刊论坛专家观点荟萃




猪年祝你发Nature~
魏勇等-Nature Astronomy:中国的行星探索路线图

光催化,今日《Nature》!

今年热怕了?Nature子刊:别急,未来4年可能更热

浙江大学最新Nature!

大型恒星比想象的更多

黑磷,再发Nature!

新突破! 二维实验系统成功应用于四维材料研究